摘要:LncRNA在胰腺癌(PC)肿瘤发生和进展中发挥重要的调节作用。我们旨在研究lncRNACERS6-AS1在PC中的作用。通过PCR分析确定PC组织和细胞系中的CERS6-AS1表达。CERS6-AS1在增殖、迁移、侵袭和上皮间质转化(EMT)中的作用通过CCK-8测定、EDU测定、transwell测定、伤口愈合测定和蛋白质印迹测定得到证实。此外,CERS6-AS1与其靶基因之间的相互作用通过荧光素酶报告测定和RIP测定进行了验证。进行动物试验和临床数据分析以验证体内功能。我们发现lncRNACERS6-AS1在PC组织和细胞中高表达。此外,CERS6-AS1的高表达与预后不良明显相关。功能分析表明,CERS6-AS1下调显着抑制了PC细胞的生长和迁移。此外,CERS6-AS1作为miR-217-5p(miR-217)的分子海绵发挥作用,miR-217被确认为CERS6-AS1的潜在靶标。随后,miR-217通过直接靶向YWHAG抑制PC细胞增殖和转移,YWHAG与RAF1相互作用并促进其磷酸化,导致RAF1介导的ERK信号激活和磷酸化ERK从细胞质转移到细胞核。在机械上,CERS6-AS1沉默通过miR-217/YWHAG/RAF1信号轴显着抑制PC细胞增殖和转移。CERS6-AS1在PC中作为致癌物发挥促进恶性特征的作用,并作为miR-217的竞争性内源性RNA。

胰腺癌(PC)是一种恶性程度高的消化道肿瘤,死亡率高,5年生存率不到10%。尽管在手术和放化疗方面取得了显着改善,但复发率和死亡率仍然很高。目前,根治性切除仍然是PC最有效的治疗方法。然而,PC患者往往早期症状不明显,因动静脉侵犯或远处转移而失去手术治疗机会。因此,迫切需要阐明PC的潜在分子机制,探索有效的生物标志物和新的治疗靶点,以实现更好的个体化治疗,改善PC患者的预后。
长链非编码RNA(lncRNA)被定义为一类长度超过200个核苷酸的非蛋白质编码转录物。它们参与多种生物学过程,如细胞分化、增殖、凋亡、血管生成等。越来越多的证据表明,lncRNA的异常表达与癌症进展显着相关。据报道,LncRNACERS6-AS1在乳腺癌和肝细胞癌中发挥致癌作用。然而,CERS6-AS1在PC中的功能和潜在分子机制仍然知之甚少。
MicroRNA(miRNA)是一组众所周知的非编码小RNA,通过直接结合目标mRNA的3'-非翻译区(UTR),在mRNA降解或转录后基因沉默中发挥其调节作用。深入研究表明,lncRNAs通过作为ceRNAs海绵miRNAs在恶性肿瘤中发挥重要作用。具有该功能的lncRNAs可以吸附miRNAs,间接释放miRNAs对其靶基因的抑制作用。
最近的证据表明,lncRNA参与调节恶性表型,例如增强细胞增殖、耐药性、远处转移和血管侵袭。有趣的是,一些lncRNA失调并在癌症进展中充当肿瘤启动子或抑制子。在本研究中,旨在阐明CERS6-AS1在PC进展中的功能和潜在分子机制。
方法与结果
在本研究中,证实了CERS6-AS1主要位于PC细胞的细胞质中,这是其作为ceRNA发挥作用的基础。生物信息学分析表明CERS6-AS1可能与miR-217结合。miR-217参与多种癌症的调控,如前列腺癌、肺癌、甲状腺癌、PC等。随后,通过荧光素酶报告基因和RIP分析证实了miR-217和CERS6-AS1之间的相互作用。然后,进一步确定CERS6-AS1通过海绵miR-217调节YWHAG的表达来促进PC细胞增殖、迁移和侵袭。实验结果显示,CERS6-AS1在PC组织/细胞中显着过度表达,并且与恶性临床病理特征和不良预后呈正相关(见图一、表一)。CERS6-AS1敲低在体外和体内抑制细胞增殖和转移(见图二、图三)。进一步的研究表明,CERS6-AS1通过海绵miR-217-5p(miR-217),抑制PC增殖和侵袭(见图四);CERS6-AS1通过靶向miR-217/YWHAG轴促进细胞生长和侵袭(见图五);YWHAG与RAF1结合并激活ERK信号(见图六);CERS6-AS1通过miR-217/YWHAG/RAF1轴激活ERK信号,促进PC细胞增殖和转移(见图七)。
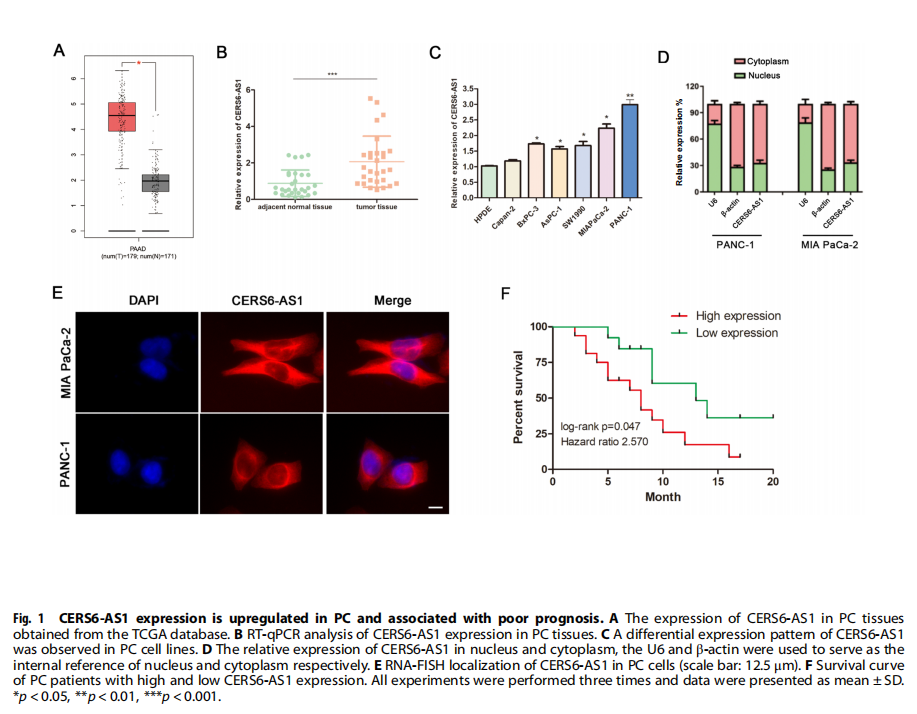
(图一)

(图二)
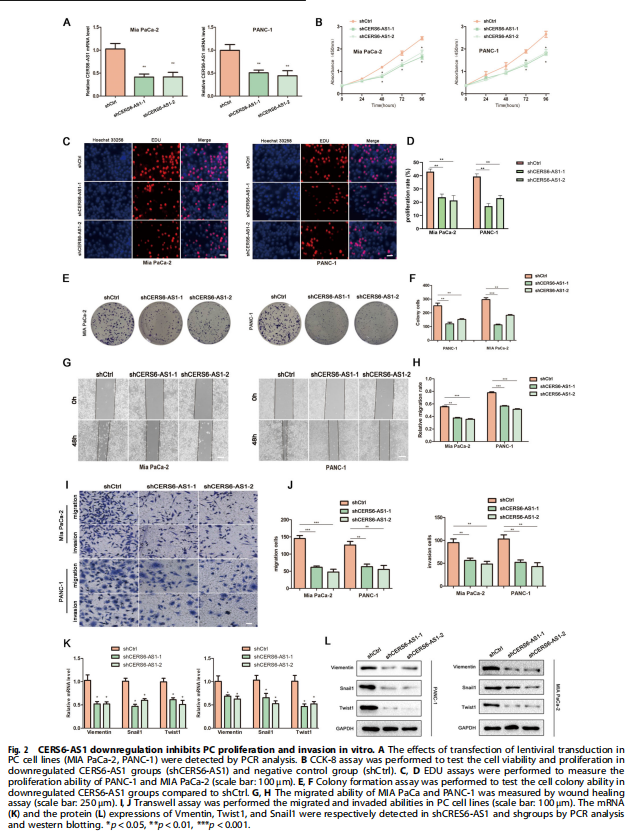
(图三)

(图四)
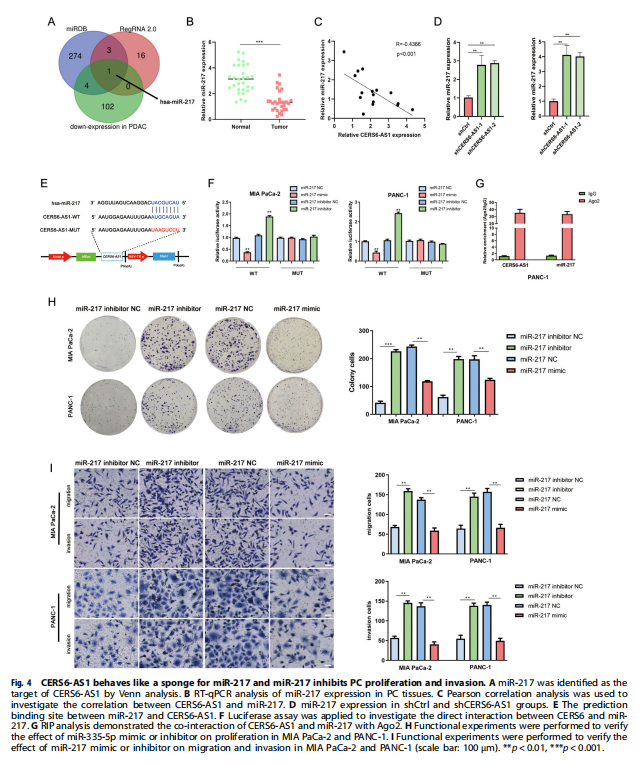
(图五)

(图六)

(图七)
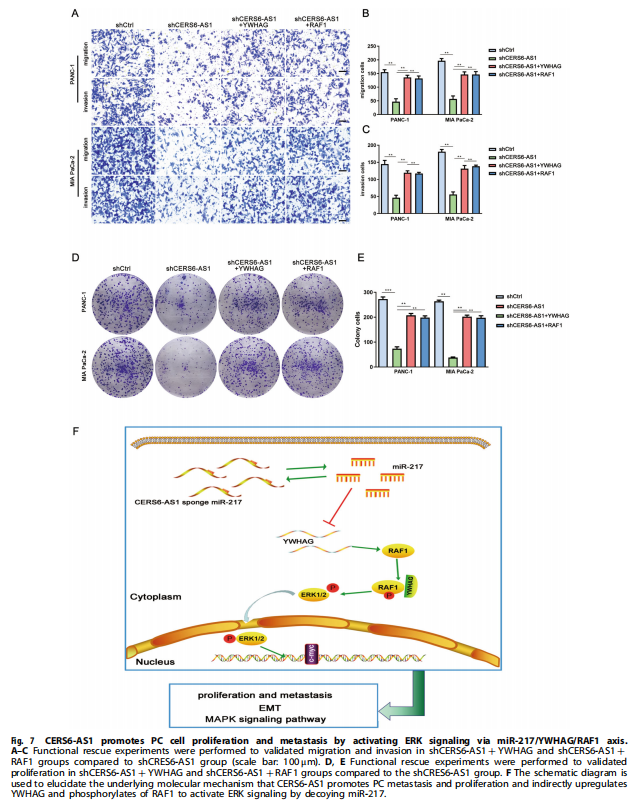
(图八)
结论
总之,本研究提供了CERS6-AS1在PC组织和细胞中过度表达的证据,其水平与淋巴结转移、较大的肿瘤大小和较差的总生存率直接相关。CERS6-AS1吸收miR-217并间接上调YWHAG的表达,YWHAG与RAF1相互作用并促进其磷酸化,从而激活ERK信号。简而言之,CERS6-AS1/miR-217/YWHAG/RAF1信号轴可能为特定诊断或个体化治疗提供生物标志物。
文章出自:细胞实验 想了解请登录:http://www.do-gene.com/




