摘要:
自噬有助于液滴的选择性降解,包括 P-Granule、Ape1-复合物和 p62/SQSTM1-body,尽管选择性降解的分子机制和生理相关性尚不清楚。在本报告中,描述了内源性p62小体的特性、自噬体生物发生对这些小体的影响,以及它们在体内的转换意义。p62-body是含有泛素和核心自噬相关蛋白的低流动性凝胶。在p62凝胶上形成多个自噬体,定位于自噬体的Atg8蛋白与p62的相互作用将自噬体的形成导向p62凝胶。Keap1还以p62结合依赖性方式可逆地易位到p62-gels以激活转录因子Nrf2。缺乏Atg8相互作用依赖性选择性自噬的小鼠表明,p62-凝胶的周转受损导致体内Nrf2过度活化。这些结果表明p62-凝胶不是自噬的简单底物,而是作为自噬体形成和抗氧化应激的平台。

介绍
巨自噬(此后被称为自噬)在溶酶体定义为细胞内蛋白质降解途径。自噬的第一步是形成一个单膜囊,称为隔离膜/吞噬细胞,靠近内质网 (ER)。隔离膜/吞噬细胞隔离细胞质的一部分,形成双膜结构,自噬体。自噬体与溶酶体融合,将隔离的物质降解为氨基酸等结构单元。自噬有两种模式:批量自噬和选择性自噬。前者负责代谢适应,后者有助于细胞稳态。实际上,自噬缺陷的小鼠对代谢压力很敏感,并且由于错误折叠的蛋白质和受损细胞器的积累而导致细胞变性。这两种模式都由核心自噬相关 (ATG) 蛋白驱动,但它们之间的一个明确区别在于,自噬体要么随机隔离细胞质成分,要么沿着特定的货物形成。特定的自噬货物,如液滴、受损或过量的细胞器和聚集蛋白出现在细胞质中,随后用泛素标记,导致接头蛋白组装,如与泛素链结合的 p62、NBR1、NDP52、OPTN 和 TAX1BP1。或者,跨膜类型的适配器蛋白,如 NIX、FAM134 和 TEX264,直接定位在货物上。在跨膜接头的情况下,不需要泛素等分子标记。核心自噬相关蛋白,例如 200 kDa的 FAK 家族激酶相互作用蛋白 (FIP200) 也通过与接头蛋白的相互作用识别标记的靶标,开始围绕目标形成自噬体的过程。泛素结合型和跨膜型衔接蛋白,均具有 LC3 相互作用区/GABARAP 相互作用基序,称为 LIR/GIM 以与定位自噬体的 ATG8 家族蛋白(包括 LC3A、LC3B、LC3C、γ-氨基丁酸受体相关蛋白 (GABARAP)、γ-氨基丁酸受体相关蛋白样 (GABARAPL)1和GABARAPL2) 围绕货物。迄今为止,针对Atg基因的基因靶向揭示了自噬的各种生理功能,但专注于选择性自噬的膜动力学和生理作用并不为人所知。在此,我们研究了内源性 p62/SQSTM1(以下称为p62)结构的特性,它们是自噬选择性底物的代表。我们阐明了针对 p62 结构的隔离膜/吞噬细胞的膜动力学以及p62结构自噬周转的体内意义。
方法与结果
本研究利用肝细胞癌细胞系Huh-1和HyD-LIR-Venus小鼠。实验结果显示,细胞中的p62阳性结构是凝胶,p62-gels被自噬降解(见图一);p62-凝胶上的自噬体形成(见图二),自噬体对p62-凝胶的吞噬取决于LC3/GABARAP相互作用(见图三、图四)。研究进一步发现,LC3相互作用依赖性选择性自噬受损,p62 凝胶上的Nrf2激活(见图五、图六、图七),Nrf2激活与自噬受损的结合导致肝损伤(见图八)。
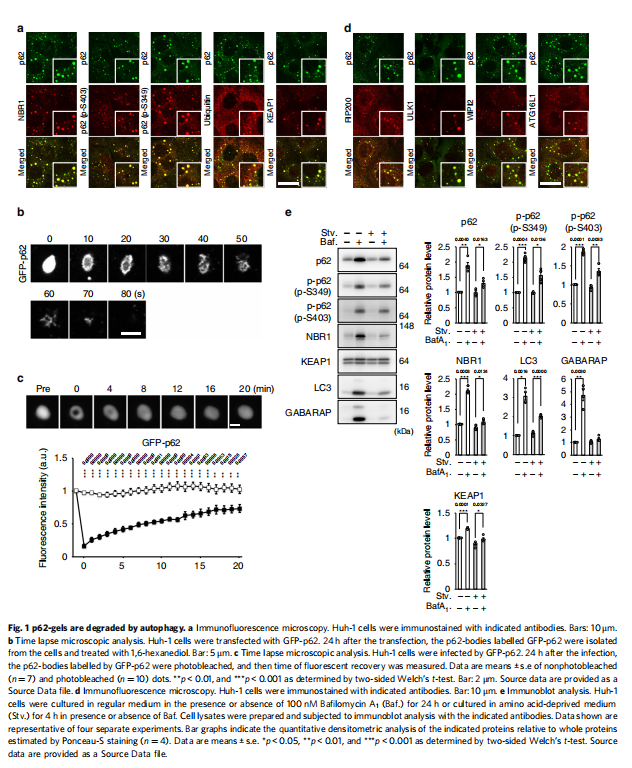
(图一)
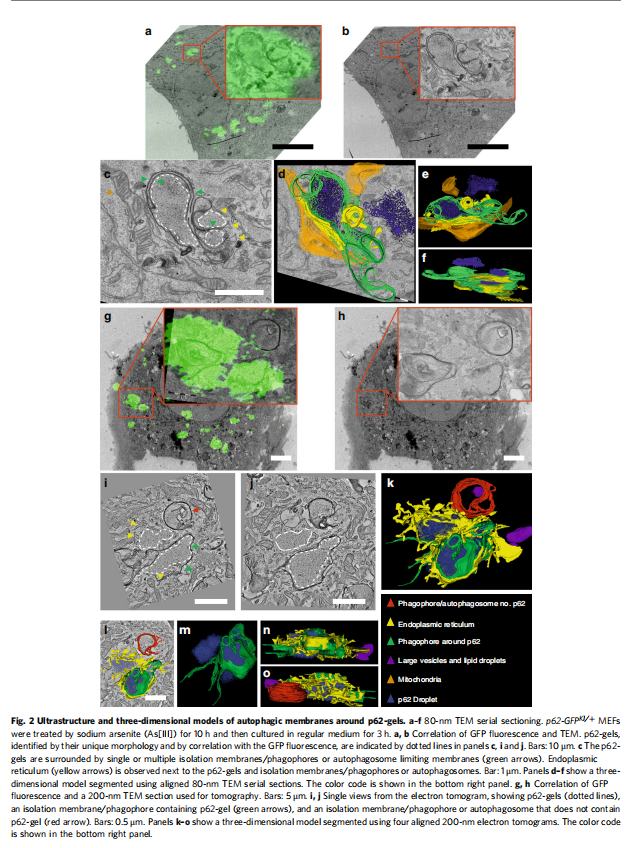
(图二)
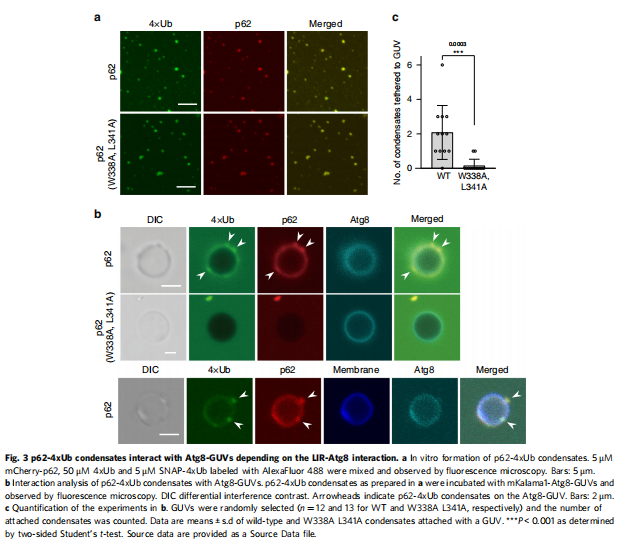
(图三)
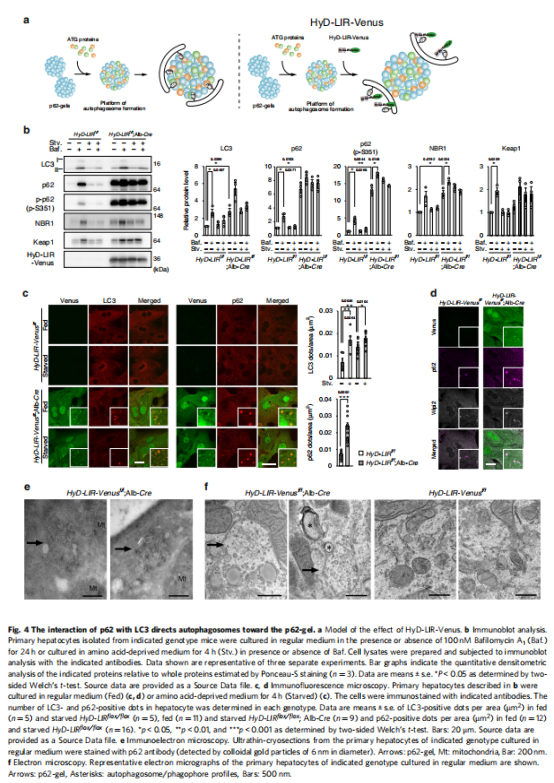
(图四)
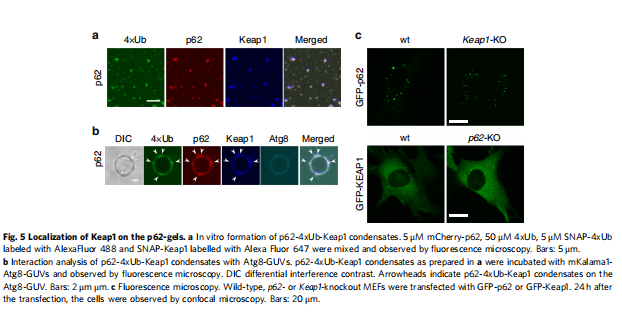
(图五)

(图六)
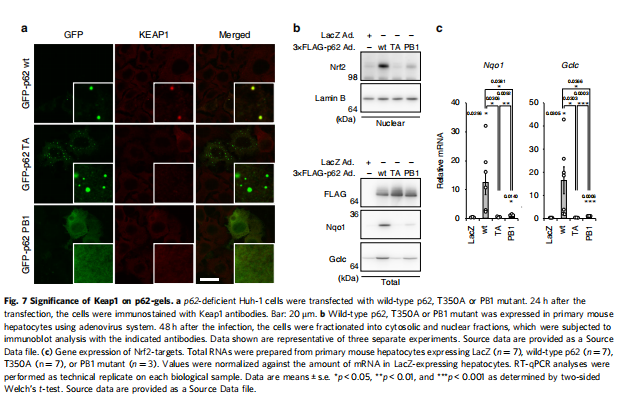
(图七)
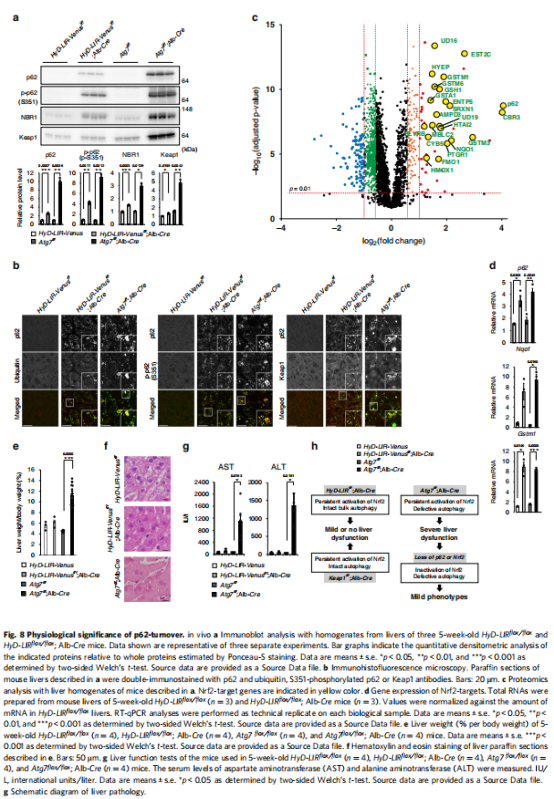
(图八)
结论
总之,本研究的数据表明内源性 p62以凝胶样结构存在,p62-凝胶作为自噬体形成和Nrf2激活的平台,并且p62介导的Nrf2激活本身没有细胞毒性。
文章出自:细胞实验外包 想了解更多请关注:http://www.do-gene.com/




