摘要:
从人诱导多能干细胞(iPSCs)中无限生成嵌合抗原受体(CAR)T细胞是“现成的”CAR-T细胞免疫治疗的一种有吸引力的方法。然而,有效地将诱导多能干细胞分化为典型的abT细胞谱系,同时保持CAR的表达和功能的方法一直具有挑战性。我们报道了从CD62L+幼稚T细胞和记忆T细胞中重新编程的诱导多能干细胞,然后进行CD19-CAR工程和3D类器官系统分化,获得了具有传统CD8αβ阳性CAR-T细胞特征的产物。与传统的CD19-CAR-T细胞相比,扩展的iPSC CD19-CAR T细胞具有相当的抗原特异性激活、脱颗粒、细胞毒性和细胞因子分泌,并保持了来自最初克隆的TCR的同质表达。iPSC CD19-CAR T细胞在体内也介导了强大的抗肿瘤活性,延长了CD19+人肿瘤异种移植物小鼠的存活时间。本研究建立了一种可行的方法,从诱导多能干细胞中生成高功能的CAR-T细胞,以支持“现成的”制造策略的发展。

介绍
嵌合抗原受体(CAR)T细胞免疫疗法是一种革命性的癌症治疗方法,在治疗造血系统恶性肿瘤方面取得了巨大成功,并显示出对抗实体瘤的潜在前景。目前的自体CART生产策略需要个性化的血液成分和制造,这对其广泛应用构成了主要障碍,例如成本高、生产效率低且不安全、剂量有限以及T的内在变异。细胞适应度。有人提出,这些障碍可能会通过从同种异体健康供体或诱导多能干细胞(iPSC)中产生“现成的”CART细胞产品来克服。
原代人类T细胞,无论是自体的还是同种异体的,都具有有限的离体扩增潜力,并在细胞培养后逐渐耗尽。相比之下,iPSC几乎可以无限增殖,同时保持其多能性和谱系分化潜力,使它们成为一个有吸引力的细胞群,从中产生无限供应的CART细胞。iPSC的进一步基因编辑也被证明是扩大免疫相容性的可行策略,从而进一步支持它们创造“现成”细胞产品的潜力。然而,研究也揭示了干细胞体外T细胞发育的复杂性以及CAR表达对T细胞分化途径的干扰。迄今为止,已报道的研究为iPSC分化以产生CART细胞建立了概念证明,这些研究证明了先天的γδT细胞样谱和扭曲的CART细胞功能。最近,开发了一种3D类器官培养系统,以成功地从造血干细胞和胚胎干细胞(ESC)中生成功能性成熟T细胞;然而,尚未报道通过这种方法成功生成CART细胞。有趣的是,这种ESC衍生的T细胞显示出不可预测的TCR库,而来自TCR转导的ESC或T细胞衍生的iPSC(TiPSC)的T细胞保留了预测的TCR表明,先前存在的TCR对T细胞分化具有定向作用。因此,我们假设使用TiPSC和3D培养系统来生成CART细胞将促进具有更常规表型和改进功能的T细胞的生产。
方法与结果
在本研究中,利用了源自原代CD62L+幼稚和记忆T细胞(Tn/mem)的iPSC克隆,评估了REM扩增的iPSC CD19-CAR T细胞在体外裂解表达CD19的靶标的效应功能。研究结果显示,产生具有传统T细胞表型的iPSC衍生的CAR T细胞(见图一);iPSC衍生的CAR T细胞的转录谱(见图二);iPSC衍生的CAR T细胞的功能分析(见图三);iPSC衍生的CAR T细胞的抗肿瘤功效(见图四、图五)。
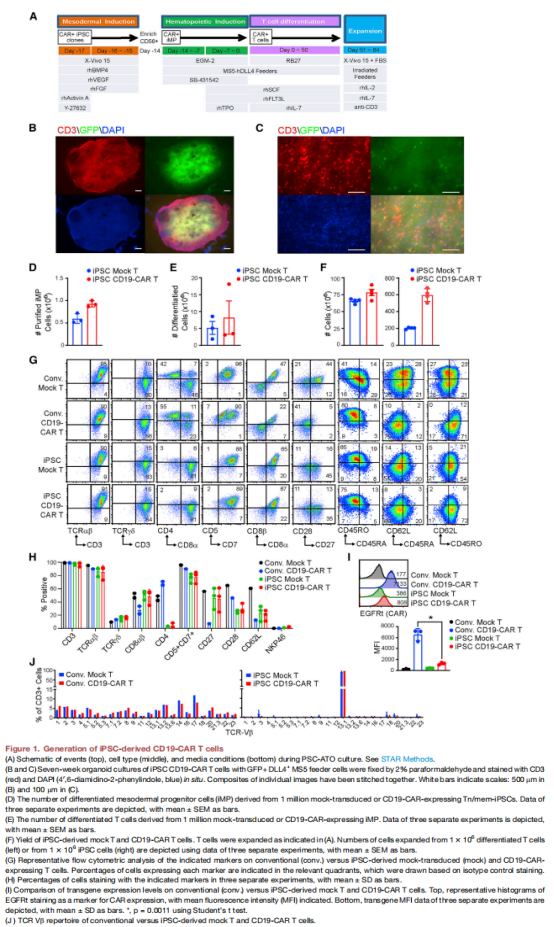
(图一)
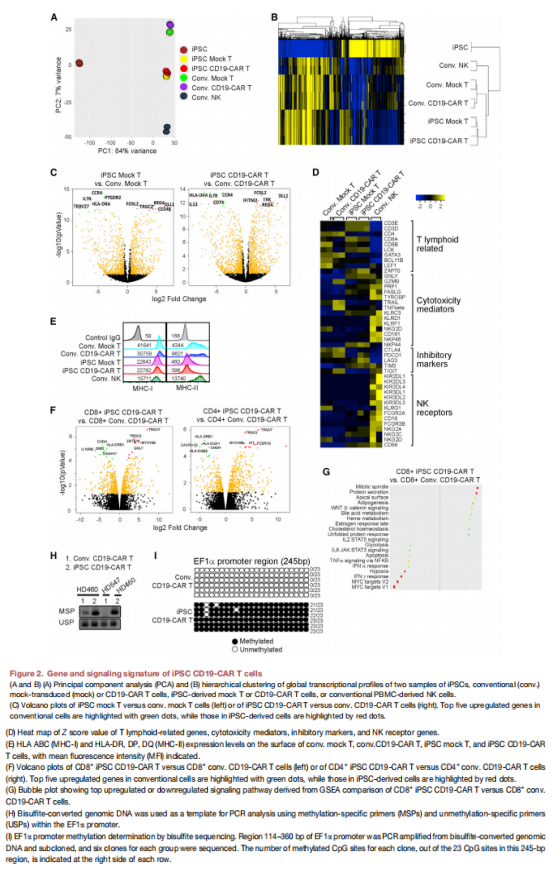
(图二)
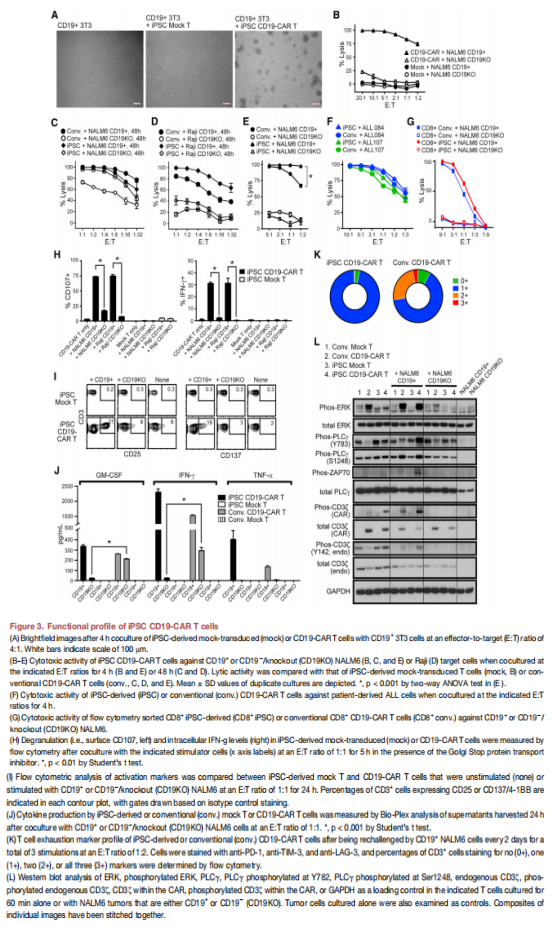
(图三)
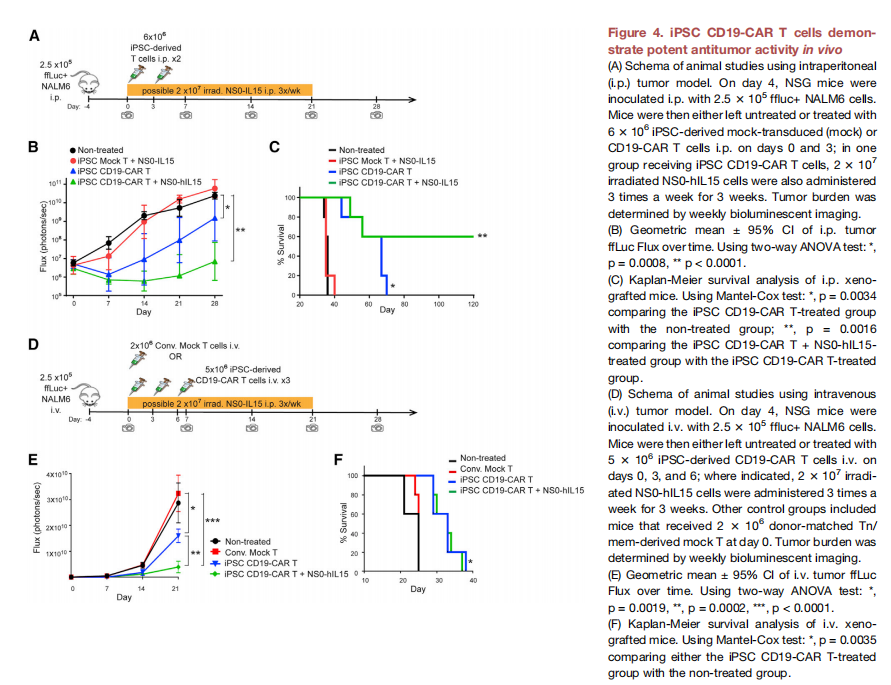
(图四)

(图五)
结论
本研究建立了一个有效的iPSC分化平台,以产生具有典型T细胞表型和CAR T功能的CAR T细胞,从而支持进一步的临床转化。这将需要建立符合GMP的iPSC线,具有指定的TCR库分化潜力、稳健、可扩展和符合GMP的基因工程系统、CAR+ iPSC定向分化和扩展到CAR T细胞产品等。重要的是,作者的研究证明iPSC-ATO 3D培养可用于生成含有不同临床相关CAR结构的T细胞,例如CD19-CAR和CLTX-CAR。临床转化的另一个关键考虑因素是确保iPSC CAR T细胞的移植物抗宿主和/或宿主抗移植物潜力可忽略不计。然而,这种基因操作如何进一步影响iPSC细胞的功能性CAR T细胞发育仍在探索中。总之,本研究提出了一种可行的方法,使用源自Tn/mem的CAR表达iPSC细胞和PSC-ATO培养物来生成具有典型T细胞表型和常规CAR T细胞属性的CAR T细胞,并支持临床转化的进一步优化。
文章出自:细胞实验外包 想了解更多请关注:http://www.do-gene.com




