血管生成又称为血管新生,是指新血管从已存在的血管中形成的生物过程。这一过程对于组织修复、生长以及在某些疾病状态如癌症中的病理改变中扮演着关键角色。那么关于血管生成有什么课题设计思路呢?今天我们一起来探讨一下。
今天我们将分享一篇发表于中科院1区期刊Pharmacological Research,影响因子为9.1的文献,希望能给大家带来不一样的灵感。
一、SCI信息

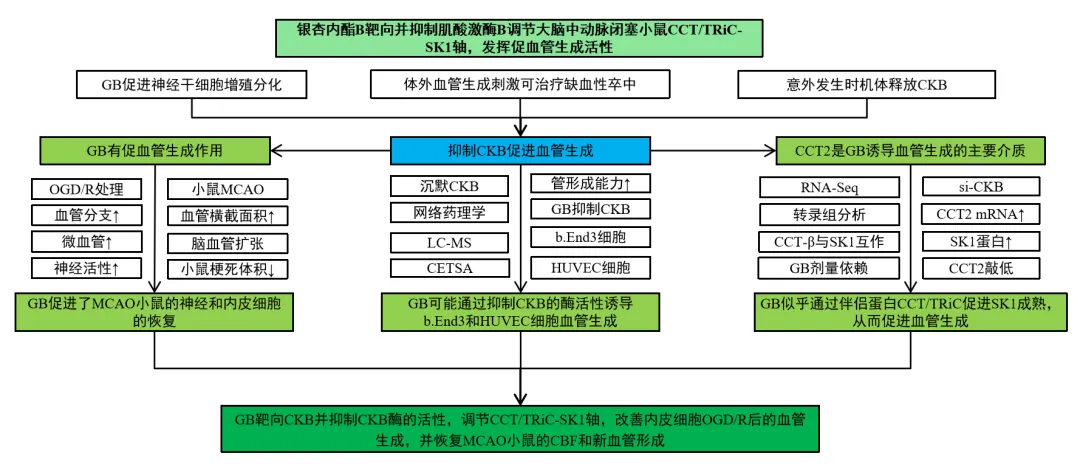
【文章题目】:银杏内酯B靶向并抑制肌酸激酶B调节大脑中动脉闭塞小鼠CCT/TRiC-SK1轴,发挥促血管生成活性
【发表期刊】:Pharmacological Research
【影响因子】:9.1/中科院1区
二、研究背景
三、技术路线
四、研究结果
此前有研究表明,急性期卒中患者肌酸激酶B(CKB)酶活性和血清水平显著升高,可达正常水平的两倍,预后较差。通过图1A~G的实验发现,沉默CKB后其mRNA和蛋白表达下降,且人脐静脉内皮细胞(HUVEC)的增殖和迁移能力大大增强。图1H~I的管形成能力检测结果显示si-CKB组的节点和连接数量显著增加,网状数增加最多,管形成能力增强。而图1J的RNA测序分析细胞转录组显示富集程度最高的10个基因,胞粘附、迁移和血管生成是受这些基因调控的主要生物活动。此外,如图1K所示,沉默CKB导致大多数正调控血管生成相关基因的表达显著增加,负调控血管生成相关基因的表达显著降低,表明靶向CKB是促进血管生成的新策略。

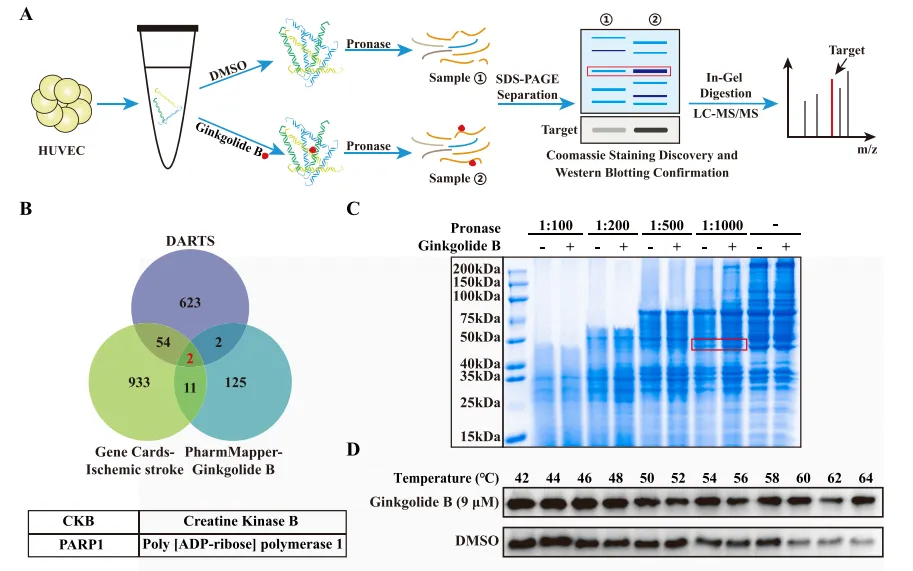
接下来,研究者在图2A~B中结合网络药理学和LC-MS,鉴定出两个下游靶蛋白:PARP1和CKB。图2C~D的SDS-PAGE和CETSA结果表明,银杏内酯B(GB)处理在保存CKB蛋白免受温度依赖性降解方面比DMSO更有效。其次,在图2E中他们利用dart测试,证明了GB诱导的稳定保护CKB蛋白免受链霉蛋白酶(pronase)水解。如图2F~G所示,他们确定了CKB酶的活性。综上,GB可能通过抑制CKB的酶活性而不是降低CKB的表达来发挥促血管生成活性。
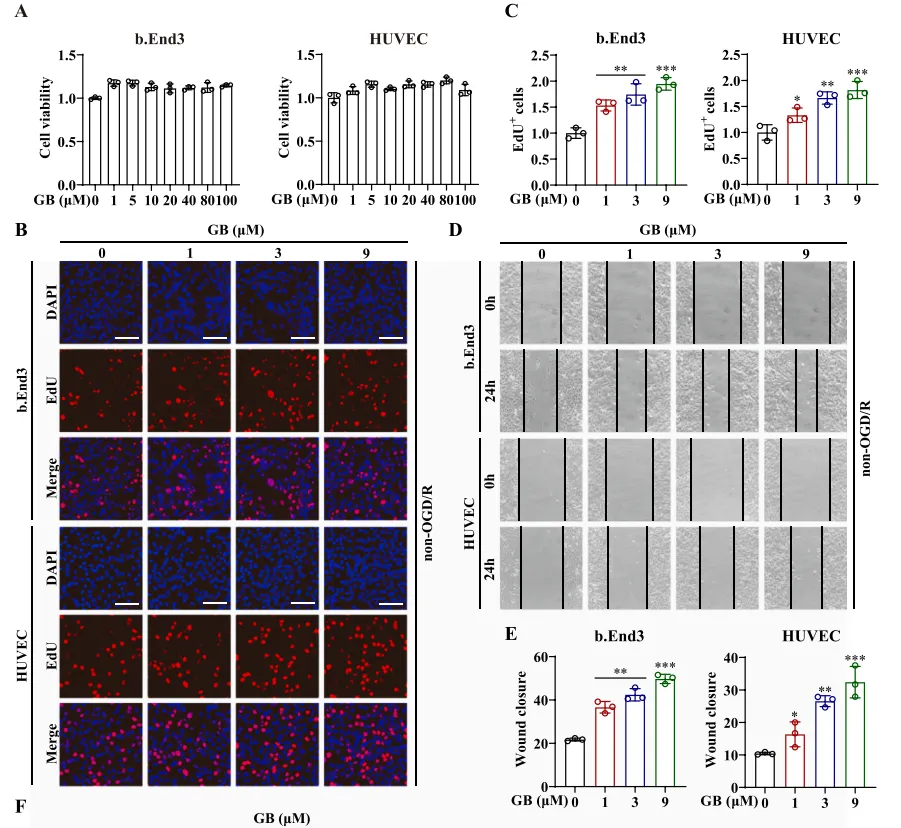
随后,他们检测了GB对小鼠脑血管内皮瘤细胞(b.End3)细胞和HUVEC细胞的促血管生成活性的影响。图3B~E显示,GB剂量依赖性地增加了b.End3和HUVEC细胞的增殖和迁移能力。此外,如图3F~G所示,在GB处理下,节点、连接、网格的数量和总长度显著增加。综上所述,GB可诱导b.End3和HUVEC细胞血管生成。
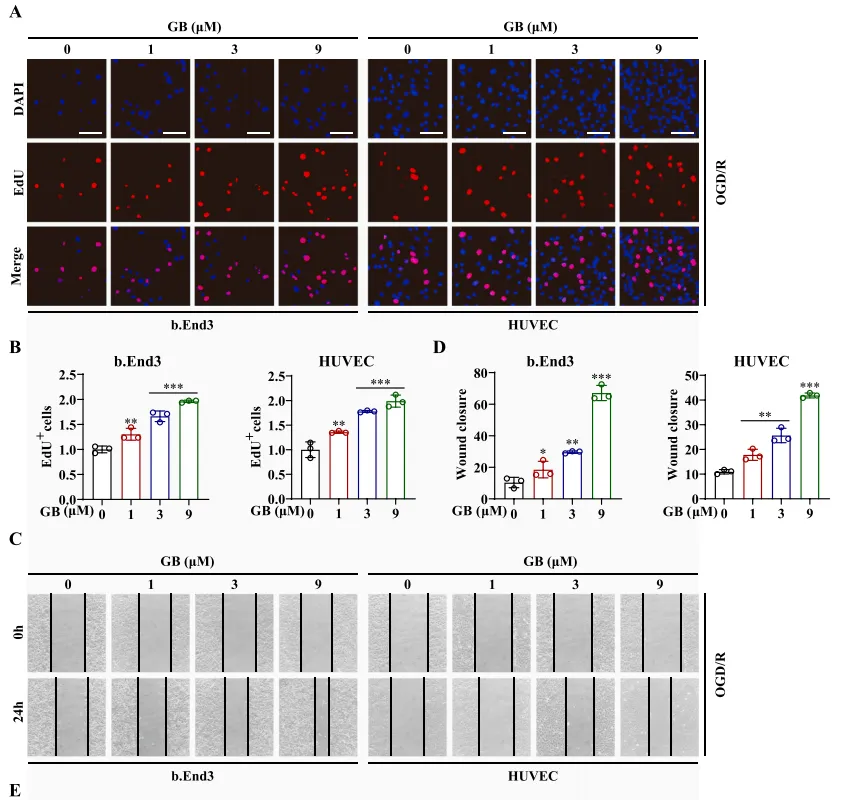
缺血性脑卒中患者由于缺乏脑血流而发生脑区域坏死,导致脑内皮细胞中的葡萄糖和氧气被剥夺。为了复制这一致病过程,他们在体外用氧糖剥夺/再灌注(OGD/R)处理b. End3细胞和HUVEC细胞,并在体内构建脑中动脉闭塞(MCAO)小鼠模型。在体外,如图4A~F所示,GB增强了OGD/R损伤后b.End3细胞和HUVEC细胞的增殖、迁移和成管能力,这证实了GB可以修复ECs的OGD/R损伤。
体内实验以银杏黄酮苷和银杏内酯为主要成分的治疗脑循环障碍的市售药物YKT注射液为阳性对照。与模型组相比,YKT和GB组小鼠脑血流量(CBF)和血管分支均显著增加,且新建立的微血管更多,血管横截面积更大,脑卒中后存在脑血管扩张。此外,如图5A~J所示,EdU与CD31共定位表明,YKT和GB组均能诱导MCAO小鼠新生血管形成。综上所述,GB在OGD/R后具有促进血管生成的作用,并且能够增加脑血流,促进小鼠缺血性脑卒中急性期脑血管新生。
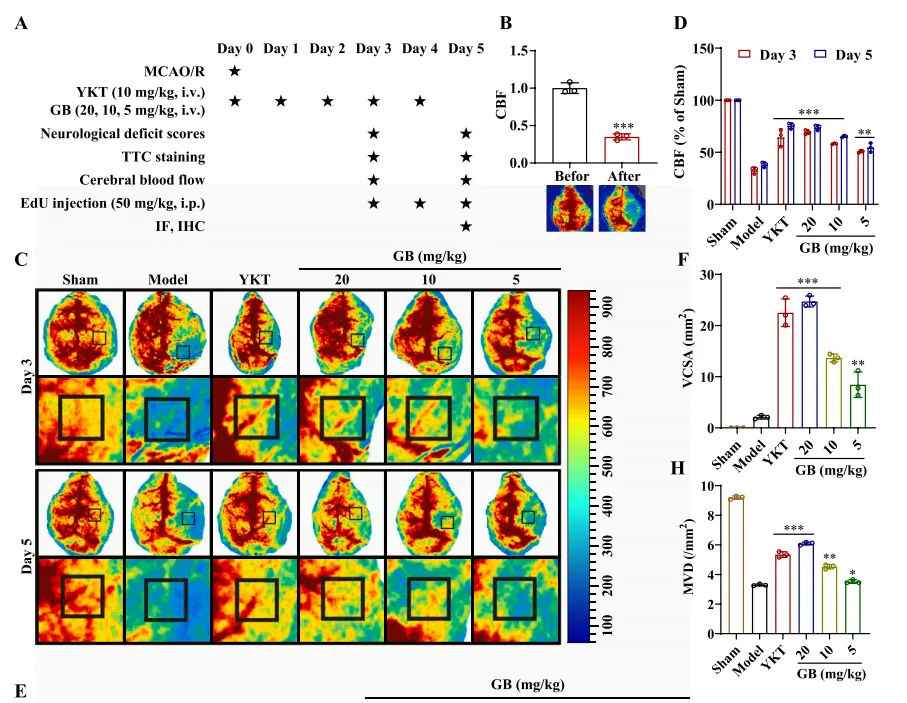
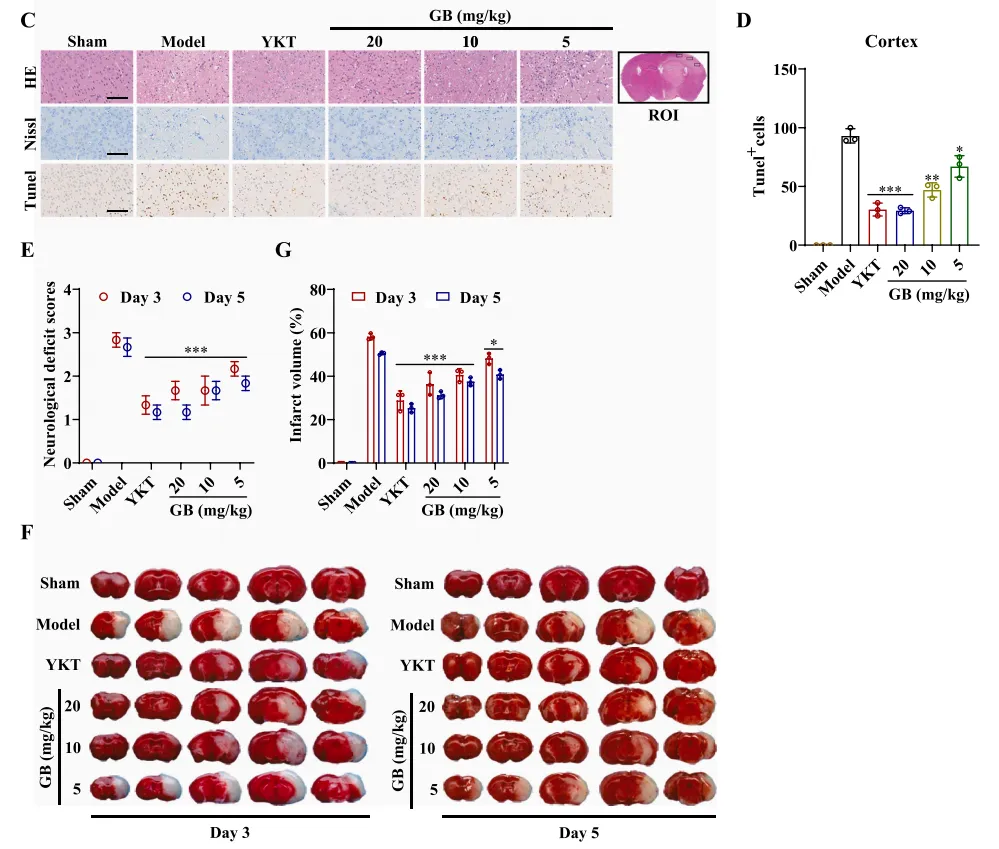
如前所述,血管生成通常与神经功能的恢复有关。在小鼠中,他们检查了海马区域和梗死皮质周围区域(缺血半暗区)。图6A~D显示,根据海马区域的HE染色,假手术组没有梗死,细胞形状正常,细胞间结构致密。高剂量组(20mg/kg)和中剂量组(10 mg/kg)的GB均有不同程度的改善,且有不同程度的神经恢复活性。此外,如图6E~G所示,神经功能缺损评分结果表明GB高、中剂量组对脑卒中后小鼠具有神经保护作用,TTC染色显示,YKT组和GB高、中剂量组小鼠梗死体积显著减少。结果表明,GB促进了MCAO小鼠的神经和内皮细胞的恢复。
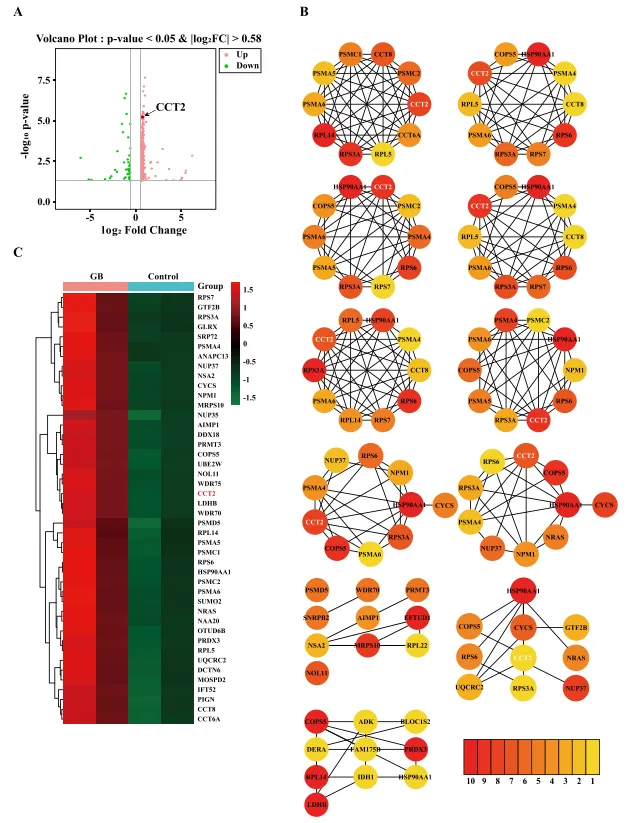
为了更好地阐明GB促血管生成活性的潜在机制,他们利用RNA-Seq分析了HUVEC细胞的转录组。在图7A~C中,对44个候选基因进行热图分析和PPI分析。为了建立置信度,他们选择排名前11位的基因作为44个候选基因的重要基因。如图8A~C所示,对这11个基因进行串分析发现,CCT2与HSP90AA1的连接最强。此外,在图8E~H中,通过沉默CCT2发现GB诱导的细胞增殖和迁移显著被si-CCT2减少。而图8I~J的GB治疗也未能恢复CCT2沉默后降低的增殖、迁移和形成管的能力。此外,在图8K的si-CKB组中,CCT2 mRNA的表达也显著增加了2倍。因此,确定CCT2是GB诱导的血管生成的主要介质。
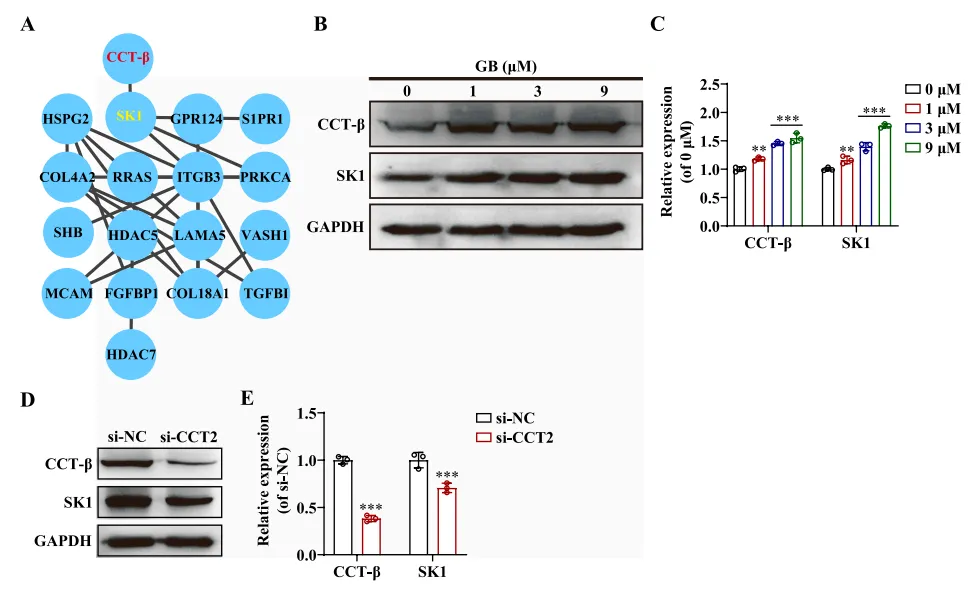
CCT家族蛋白,已被证明与人鞘氨醇激酶(SK1)相互作用,SK1是一种产生鞘氨醇1-磷酸(S1P)以诱导血管生成的酶。利用String数据库评估了CCT-β(由CCT2编码)、SK1(由SPHK1编码)和血管生成相关蛋白(由si-CKB组的DEGs编码)之间的关系,在图9A中发现CCT-β可能通过与SK1相互作用来调节血管生成。同样,图9B~C所示,当不同剂量的GB处理HUVEC细胞时,CCT-β蛋白表达显著增加,呈剂量依赖性,并且CCT-β诱导的SK1蛋白表达有增加的趋势。此外,图9D~E显示,CCT2敲低导致SK1蛋白表达降低。因此,GB似乎通过伴侣蛋白CCT/TRiC促进SK1成熟,从而促进血管生成。
五、研究小结
本研究旨在阐明GB对脑卒中后血管生成的药效学作用及其潜在机制。首先,GB显著提高b.End3和HUVEC的增殖、迁移和成管能力。此外,GB显著改善内皮细胞OGD/R后的血管生成。观察MCAO小鼠脑血流动力学、脑微血管新生和重建以及脑内皮组织完整性。通过无标记靶标检测技术,他们首次发现GB能够特异性靶向CKB并抑制其酶活性。此外,他们通过网络药理学和一系列分子生物学实验证明,GB抑制CKB,然后通过CCT/TRiC-SK1轴促进血管生成。这些发现为使用GB治疗缺血性脑卒中后神经恢复和内皮修复的新治疗策略提供了新的思路。
六、国自然中标情况

实验外包 想了解更多请关注:https://www.do-gene.com




