乙酰辅酶A (AcCoA)处于营养代谢的中枢,穿梭于规范和非规范三羧酸循环之间,该循环受营养状态(如禁食)的动态调节。
2025年11月12日,复旦大学雷群英团队在Nature在线发表题为“Cytosolic acetyl-coenzyme A is a signalling metabolite to control mitophagy”的研究论文,该研究发现,通过短期禁食和抑制ATP-柠檬酸裂解酶(ACLY编码)、线粒体柠檬酸/苹果酸反转运酶(SLC25A1编码)或酰基-辅酶A合成酶短链家族成员2 (ACSS2编码),细胞内AcCoA水平降低后可触发线粒体自噬,而补充乙酸可抵消线粒体自噬。值得注意的是,NOD样受体(NLR)家族成员X1 (NLRX1)介导了这一作用。在体外和体内,破坏NLRX1可消除胞内AcCoA还原诱导的有丝分裂。
从机制上讲,线粒体外膜定位的NLRX1在其富含亮氨酸重复序列(LRR)结构域的保守口袋内直接与细胞质AcCoA结合。此外,AcCoA结合LRR结构域并增强其与核苷酸结合和寡聚化(NACHT)结构域的相互作用,有助于维持NLRX1的自抑制状态,并阻止NLRX1与轻链3 (LC3)的关联。该研究发现AcCoA–NLRX1轴是KRAS抑制剂诱导的线粒体自噬反应的基础,并促进耐药性,提供了KRAS抑制剂耐药的代谢机制。因此,胞质AcCoA是一种信号代谢物,通过其受体NLRX1将代谢与线粒体自噬联系起来。

细胞通过两种途径选择性降解线粒体:PINK1-Parkin途径和线粒体自噬受体介导的途径。NLRX1是唯一的线粒体定位NLR,作为线粒体自噬受体,直接结合LC3介导线粒体自噬,以应对线粒体损伤。禁食通过改善线粒体质量对人体健康有益。禁食24小时后,在小鼠肌肉中观察到有丝分裂结构,并且在Pink1缺乏后保持完整。
虽然一些线粒体自噬受体可能在禁食时转录上调,但尚不清楚特定的线粒体自噬受体是否以选择性的方式介导禁食诱导的线粒体自噬。其他悬而未决的问题包括鉴定线粒体自噬受体介导的选择性线粒体自噬的新机制,以及描述癌症生物学中线粒体自噬调节的肿瘤细胞死亡。
在非典型三羧酸(TCA)循环中,线粒体柠檬酸盐通过SLC25A1输出到细胞质中,并通过ACLY分解为草酰乙酸和AcCoA,分别产生苹果酸盐和脂肪酸。AcCoA还原诱导的自噬主要依赖于其作为蛋白质乙酰化底物的典型功能。AcCoA是否以非规范的方式,如通过乙酰化和AMPK独立介导有丝自噬的营养信号,是人们非常感兴趣的。该研究发现AcCoA–NLRX1轴是KRAS抑制剂诱导的线粒体自噬反应的基础,并促进耐药性,提供了KRAS抑制剂耐药的代谢机制。因此,胞质AcCoA是一种信号代谢物,通过其受体NLRX1将代谢与线粒体自噬联系起来。
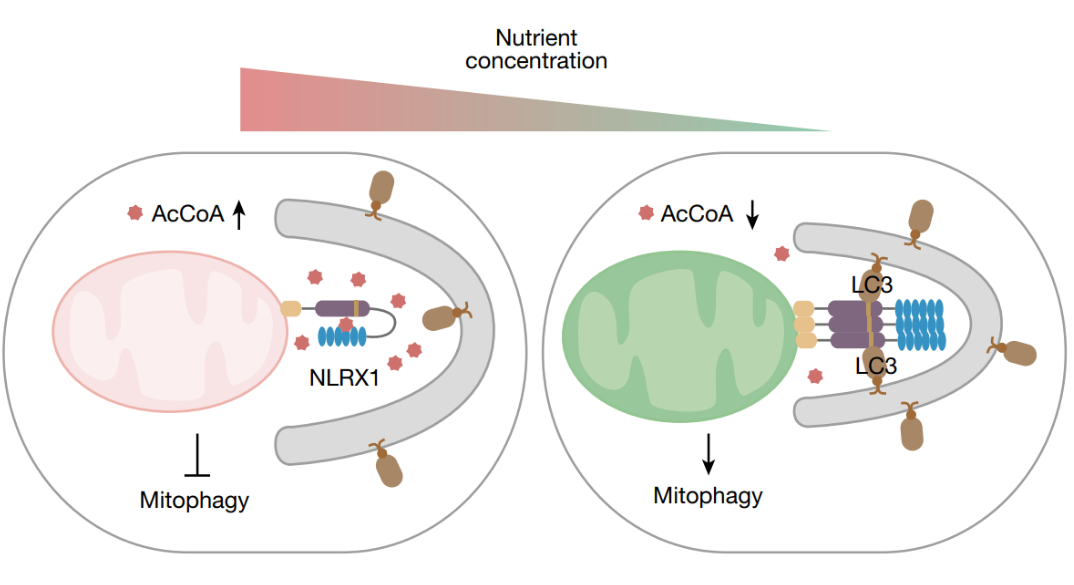
NLRX1寡聚及其与LC3在AcCoA信号传导中的关联示意图
科研实验外包 想了解更多请关注:https://www.do-gene.com




