摘要:
铁死亡是与脂质过氧化相关的铁依赖性调节性坏死形式。尽管它在铁死亡的炎症结果中起关键作用,但对于在这种类型的细胞死亡过程中导致质膜破坏的分子事件知之甚少。在这里,作者表明细胞溶质Ca2+的持续增加是细胞完全破裂之前的铁死亡的标志。本文报告说,导致铁死亡的质膜损伤与半径几纳米的膜纳米孔有关,并且渗透保护剂可以延迟铁死亡,而不是脂质过氧化。重要的是,Ca2+铁死亡过程中的通量会诱导ESCRT-III依赖性膜修复机制的激活,从而抵消细胞死亡的动力学并调节铁死亡的免疫学特征。我们对铁死亡的发现提供了一个统一的概念,即质膜破裂前胞质Ca2+的持续增加是受调节的坏死类型的一个共同特征,并且将ESCRT-III激活定位为这些裂解细胞死亡途径中的一般保护机制。

介绍
铁死亡是一种不依赖半胱天冬酶的调节性坏死形式,其特征是在细胞膜中产生铁依赖性脂质过氧化物。通过铁死亡而死亡的细胞的特征是质膜破裂和释放其他受限的细胞内成分,包括促炎性损伤相关的分子模式。因此,铁死亡这种类型的细胞死亡与坏死性炎症和先天免疫系统的激活有关。铁死亡已被证明会导致缺血/再灌注损伤、组织损伤和器官死亡,以及其他几种病理,包括神经退行性疾病和癌症。由于这些原因,了解控制铁死亡期间膜破裂的分子机制不仅具有生物学意义,而且具有医学意义。
与具有特定激动细胞机制来介导细胞死亡的其他细胞死亡途径相比,铁死亡似乎是在抑制铁死亡拮抗剂后执行的。铁死亡的最佳触发因素是谷胱甘肽过氧化物酶4(GPX4)的消耗或抑制,这是一种独特的酶,负责将膜中的过氧化磷脂还原为脂醇。使用直接抑制GPX4的Ras选择性致命小分子3(RSL3)或使用Erastin-1(通过降低其共底物谷胱甘肽的水平来影响GPX4的活性)进行治疗是诱导铁死亡的广泛使用的方法。
方法与结果
在本研究中,首先,作者研究了在各种细胞模型中由Erastin-1和RSL3触发的铁死亡过程中质膜透化的分子机制。结果显示,胞质Ca2+的持续增加是铁死亡的标志(见图一);其次,作者使用活细胞成像和流式细胞术,研究结果显示脂质氧化先于细胞溶质Ca2+和质膜分解的增加(见图二);并同时跟踪了铁死亡不同标志的动力学,实验结果表明渗透活性剂保护细胞免受铁死亡(见图三)。最后,作者进一步将细胞溶质Ca2+的增加联系起来在ESCRT-III机制激活的铁死亡中,实验结果进一步表明ESCRT-III复合物在铁死亡过程中被激活并拮抗细胞死亡(见图四、图五)。

(图一)

(图二)

(图三)
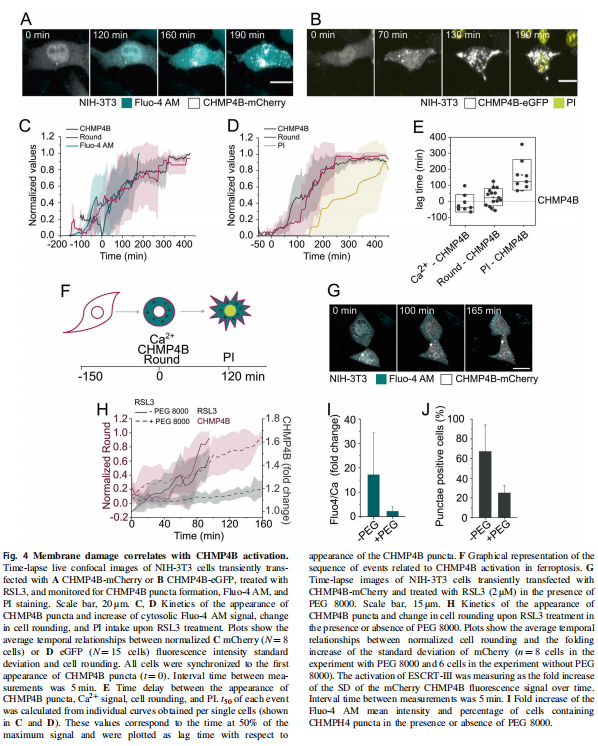
(图四)

(图五)
结论
总之,本研究定义了与GPX4失活后质膜透化相关的铁死亡的细胞特征。铁死亡途径的激活导致细胞膜中的脂质过氧化和细胞溶质Ca2+水平的持续增加,这是最终细胞破裂之前的膜损伤的结果。这些过程受渗透压控制,是由于质膜中形成几纳米的小孔而导致的。Ca2+的活化由于膜损伤引起的通量会诱导ESCRT-III机制的激活,从而抵消铁死亡以调节细胞死亡的动力学。本文关于ESCRT-III调节铁死亡微环境中细胞因子水平的结果揭示了这种机制在调节铁死亡的炎症结果中的作用。这些发现支持了一个通用模型,其中质膜孔形成和膜修复作为中心和相反的机制出现,控制不同类型的调节性坏死及其炎症特征的进展。
文章出出自:细胞实验 想了解更多请关注:http://www.do-gene.com/




