摘要:
化疗激活了一种新的细胞质脱氧核糖核酸损伤反应,导致lgi装置断裂和癌细胞存活。这一机制受高尔基体磷酸蛋白-3(golph3)/肌18a/肌动蛋白轴的调节。分析miR-3135b(一种功能未知的非编码小RNA)的功能,我们发现它的强制过表达减弱了化疗药物诱导的结直肠癌细胞高尔基体断裂。首先,我们发现miR-3135b在结直肠癌细胞系和临床肿瘤中下调。生物信息学预测表明,miR-3135b可能调节与细胞存活、化疗耐药性和高尔基体动力学相关的蛋白编码基因。一致地,miR-3135b在HCT-15癌细胞中的异位转染显著抑制细胞增殖,使细胞对5-氟尿嘧啶(5-FU)致敏,并促进晚期凋亡和坏死。此外,miR-3135b的过度表达损害了HCT-15和SW-480癌细胞的细胞周期蛋白表达。由于参与高尔基体结构维持的基因GOLPH3被预测为miR-3135b的潜在靶标,我们研究了它们对化疗诱导的DNA损伤的功能关系。使用抗反式高尔基体网络标记物——抗TGN38蛋白的抗体进行的免疫荧光和细胞超微结构实验表明,5-FU和多柔比星治疗导致HCT-15和SW-480细胞中高尔基体带状结构的非凋亡依赖性堆积扩散。值得注意的是,miR-3135b模拟物的转染极大地阻碍了这些细胞效应。此外,我们的功能研究证实,miR-3135b与3′-UTRofgolph3原癌基因结合,并且还降低了p-AKT1(Ser473)和p-mTOR(Ser2448)信号转导子的水平,这些信号转导子是细胞存活和自噬激活的关键。此外,我们发现用5-FU治疗后,TGN38因子与beclin-1自噬蛋白在与fragmentedGolgi相关的离散结构中共免疫定位,这表明促生存自噬的激活与Golgi完整性的丧失有关。miR-3135b逆转了自噬和高尔基体扩散中的这些细胞效应。总之,我们提供了实验证据,首次表明miR-3135b在保护化疗诱导的高尔基体碎片viaGOLPH3/AKT1/mTOR轴和保护性自噬中的新作用。

介绍
结直肠癌(CRC)是全球癌症死亡的第二大原因。不幸的是,超过80%的患者在疾病晚期被诊断出来,这导致对治疗的反应低和生存率低。尽管有不同的治疗策略,包括放疗和化疗与5-氟尿嘧啶(5-FU)、奥沙利铂和卡培他滨的序贯组合,但由于细胞对治疗的抵抗力增加,CRC患者的临床反应率仍然很低。这种不利情况促使定义新的治疗方法来克服耐药性并改善患者对实际治疗的临床反应。在过去的几十年里,已经在人类癌症中描述了主要通过激活所谓的“核DNA损伤反应”来实现治疗抵抗的多种分子机制。然而,最近在一项杰出的研究中报道,为了响应DNA损伤剂的化学治疗,会触发一种新的细胞质DNA损伤反应,导致高尔基体扩散和癌细胞存活。最近的实验结果表明,高尔基体膜是自噬囊泡组装和生产的重要部位,自噬囊泡在自噬10的早期阶段使形成吞噬细胞形成的膜结构成核。
在本研究中,作者研究了miR-3135b在响应5-FU和多柔比星药物时在高尔基体结构完整性和促存活自噬激活中的保护功能。实验的数据表明miR-3135b是一种新型肿瘤抑制因子,在调节GOLPH3/AKT1/mTOR轴以维持高尔基体完整性方面具有潜在作用,这为DNA损伤的新型细胞质DNA损伤反应的谜题增添了一块拼图。
方法与结果
本文为了开始研究 miR-3135b,这是一种位于染色体 6p21.32 中的非编码 RNA,以前没有参与人类癌症,我们使用干环 qRT-PCR 测定分析了其在三个 CRC 细胞系和正常结肠细胞中的表达水平。实验结果表明,MicroRNA-3135b表达在结直肠癌细胞和肿瘤中受到抑制(见图一)。为了研究 miR-3135b 的功能,我们通过使用 TargetScan 和 miRmap 软件进行生物信息学分析来搜索其潜在的基因靶标和相关的信号通路。实验结果进一步显示,MicroRNA3135b预计可调节参与高尔基体完整性的基因(见图二)。接下来,我们想知道 miR-3135b 是否可以调节细胞增殖和凋亡,并使 CRC 细胞对 5-FU 治疗敏感。研究结果显示,MicroRNA-3135b损害增殖、细胞周期进程并促进晚期细胞凋亡和坏死(见图三、四)。接下来,评估 miR-3135b 在响应化疗治疗的 GOLPH3 和高尔基体结构调节中的潜在作用。实验结果显示,MicroRNA-3135b减弱高尔基体对治疗的反应(见图五)。为了排除高尔基体片段化可能是由于细胞凋亡激活的可能性,使用共聚焦显微镜对 HCT-15 细胞中的 caspase-3 蛋白进行了免疫检测。研究进一步发现,高尔基体扩散的发生与CRC细胞的凋亡无关(见图六)。为了深入了解 miR-3135b 对药物诱导的高尔基体扩散的保护作用的分子机制,我们使用非- 处理、模拟和混杂转染的 HCT-15 细胞,以及用单独的 miR-3135b 模拟物或与 5-FU 组合转染的细胞。结果表明,MicroRNA-3135b靶向GOLPH3/AKT/mTOR轴(见图七)。作者假设促存活的自噬途径可以反过来被激活以响应化疗,这可能导致高尔基体片段的再循环,从而使癌细胞能够存活。结果显示。高尔基体扩散与自噬激活有关(见图八)。
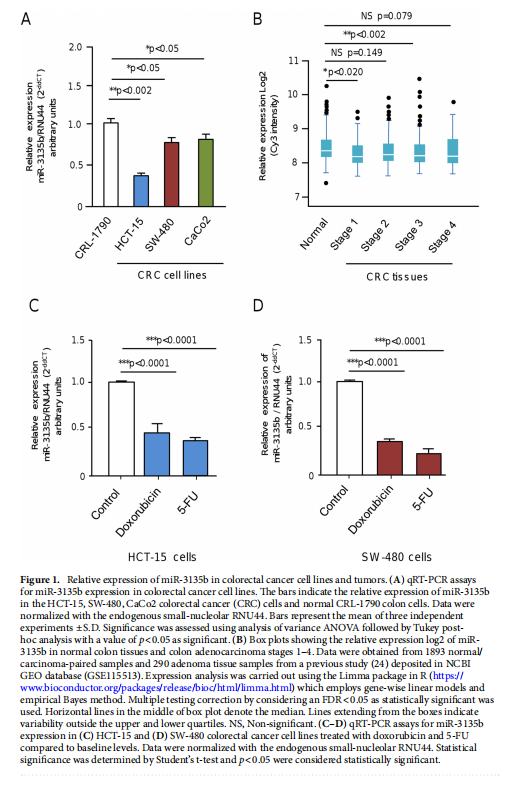
(图一)
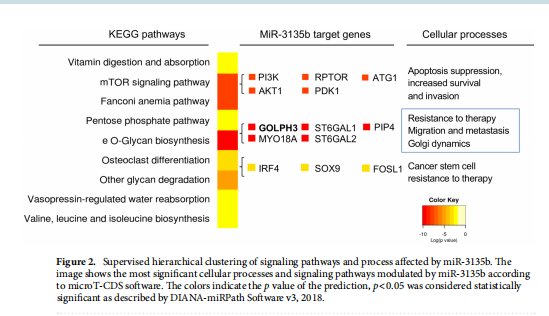
(图二)
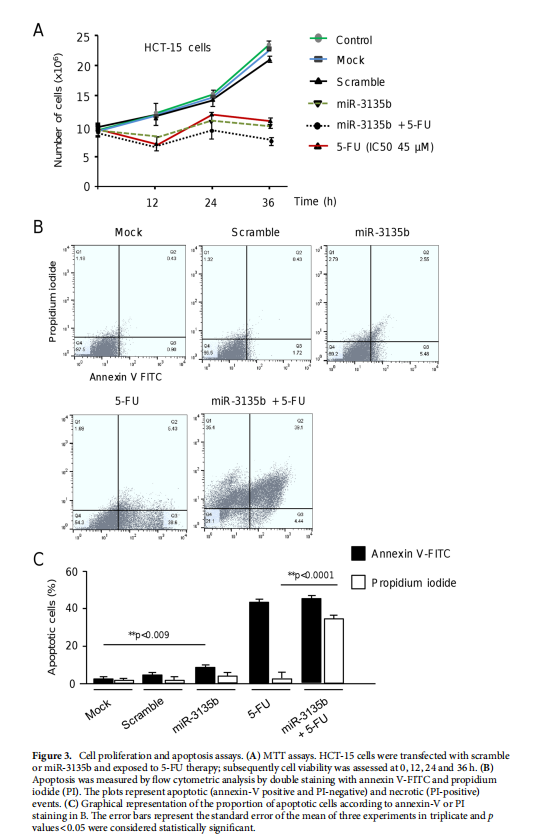
(图三)

(图四)
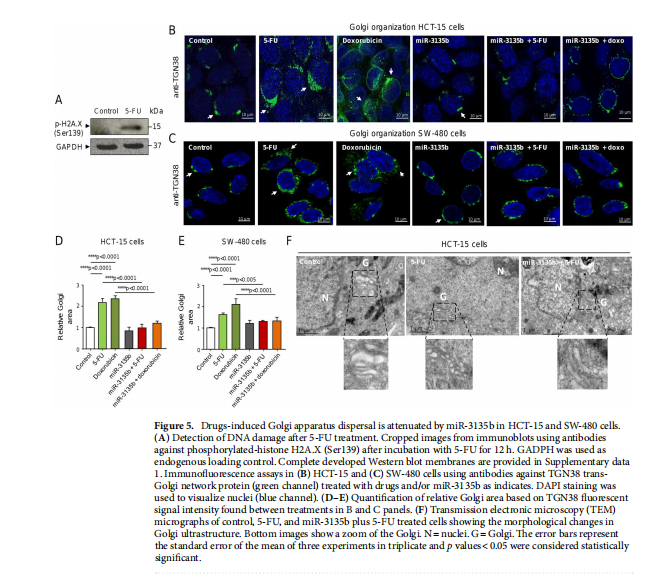
(图五)
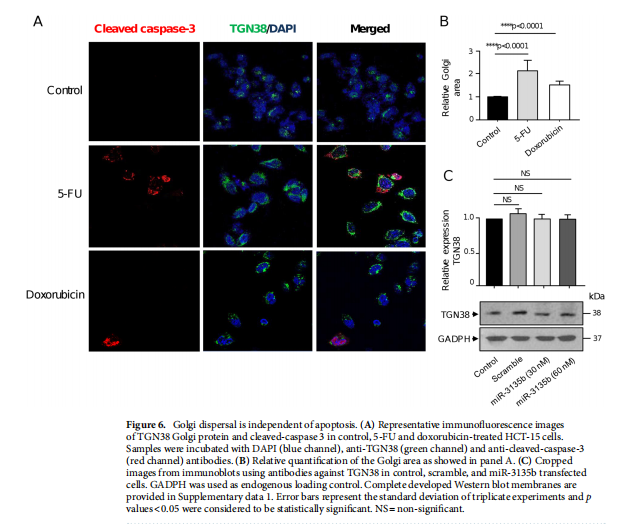
(图六)
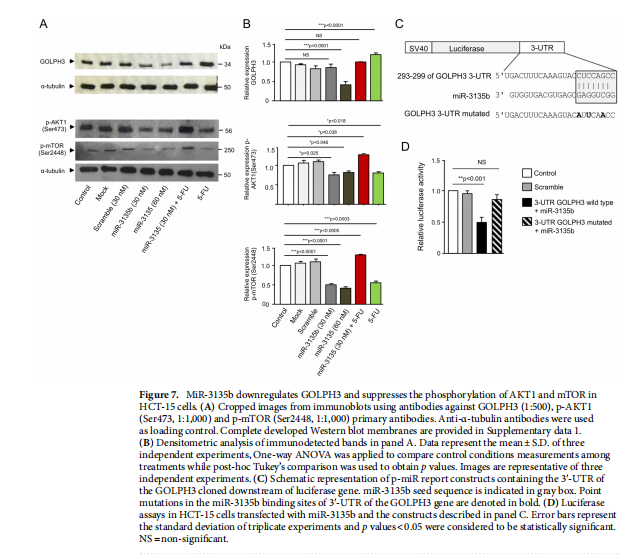
(图七)
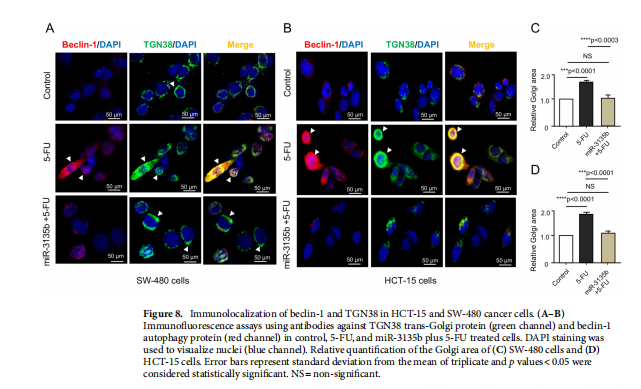
(图八)
讨论
作者知道本报告有一些局限性,应在未来的工作中加以解决:(1)这是一项基础研究,必须通过对CRC活检中miR-3135b和GOLPH3/AKT1/mTOR轴分子的分析进一步证实患者以评估其临床价值;(2)有必要评估miR-3135b在高尔基体扩散中的保护作用,以应对来自不同类型癌症的大量细胞系中的其他药物和放疗;(3)表征参与细胞质DNA损伤反应的其他miR-3135b基因靶点。总之,本研究的结果表明GOLPH3/AKT/mTOR轴受到miR-3135b的负调控,导致HCT-15和SW-480癌细胞的细胞凋亡激活和增殖能力降低和细胞周期停滞。作者还假设可以激活促存活自噬途径,这可能导致高尔基体片段的再循环,从而允许CRC细胞响应药物治疗而存活(见图九)。本文的数据还提供了关于microRNA在细胞质DNA损伤反应机制中的作用的新见解,并表明操纵miR-3135b水平可能是结直肠癌的潜在治疗工具。
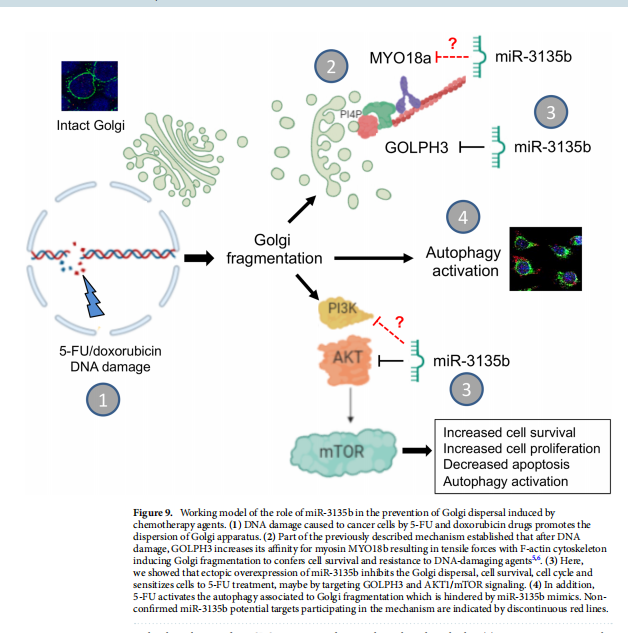
(图九)
文章出自:细胞实验 想了解更多请关注:http://www.do-gene.com/




