
介绍
细胞代谢失调是人类结直肠癌(CRC)的一个明显标志。然而,肿瘤进展过程中的代谢程序重新布线尚未完全了解。
近年来,发现miRNAs与转录因子类似,作为主基因调节因子,在包括细胞代谢在内的多种细胞活动中介导基因表达模式。已知MiRNAs在代谢重编程和肿瘤发生之间提供功能联系。在本研究中,确定了一种新的RNA结合蛋白RALY(hnrNP-与致死黄相关,也称为hnRNPCL2)作为结直肠癌(CRC)肿瘤进展的重要指标。作者在此介绍了RALY通过介导CRC中的miRNA加工在线粒体代谢重编程中的作用,并强调了在CRC治疗中靶向RALY的潜在治疗策略。
方法与结果:
我们分析了结直肠肿瘤进展过程中改变的基因特征,并使用分子和代谢分析的复合物来研究CRC细胞系、人类患者来源的异种移植小鼠模型和肿瘤类器官模型中的代谢调节。我们鉴定了一种新的rna结合蛋白RALY(也称为hnRNPCL2),它与结直肠肿瘤的侵袭性高度相关(见图一)。RALY作为Drosha复合物中的关键调控成分,并促进mirna的一个特定子集(miR-483、miR-676和miR-877)的转录后加工(见图二)。这些miRNAs系统地下调代谢相关基因(ATP5I、ATP5G1、ATP5G3和CYC1)的表达(见图六),从而重新编程癌细胞中的线粒体代谢(见图三)。对癌症基因组图谱(TCGA)的分析显示,在表达低水平线粒体相关基因的CRC患者中,RALY水平的升高与不良预后相关(见图四、图五)。在机制上,在活性氧(ROS)应激下,其n6-甲基腺苷开关促进了这些mirna的诱导加工(见图三)。抑制m6a甲基化可以消除对pri-miRNAs末端环的RALY识别。RALY的敲除可抑制体内和类器官模型中结直肠肿瘤的生长和进展(见图七、图八)。
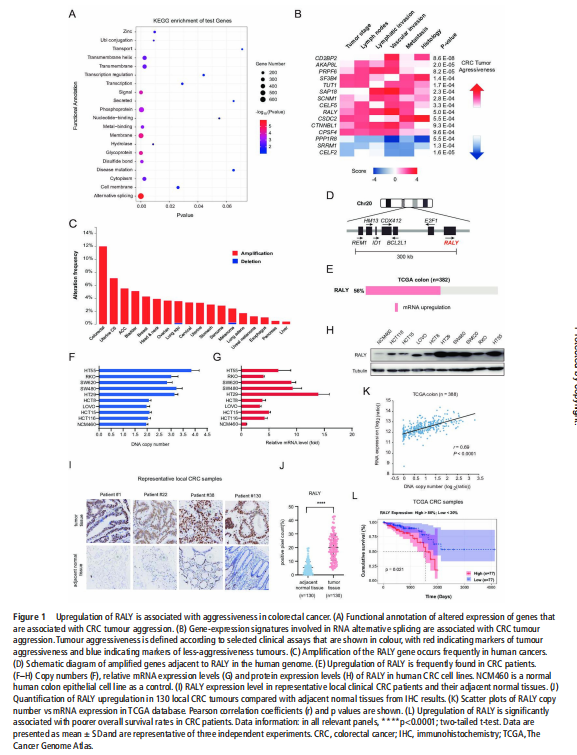
(图一)

(图二)
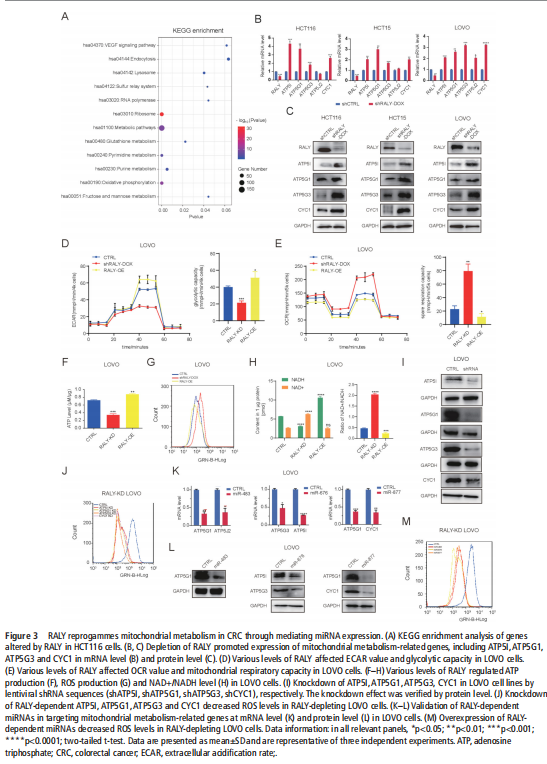
(图三)
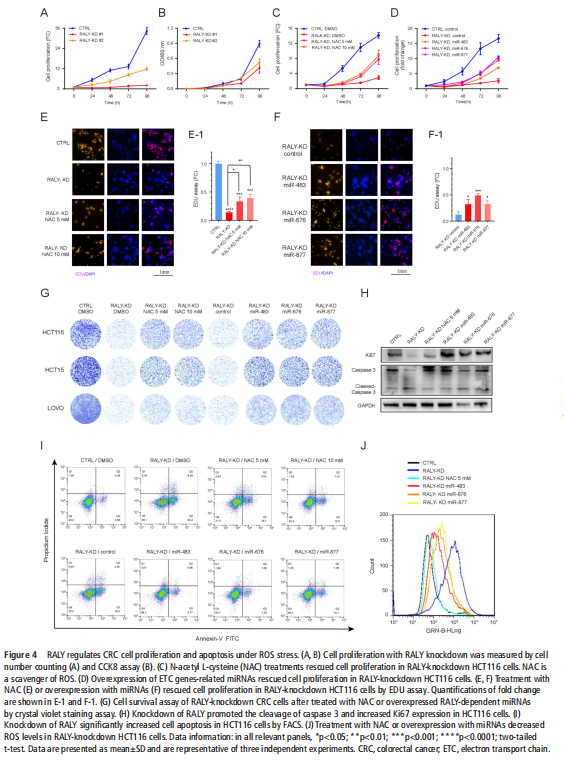
(图四)
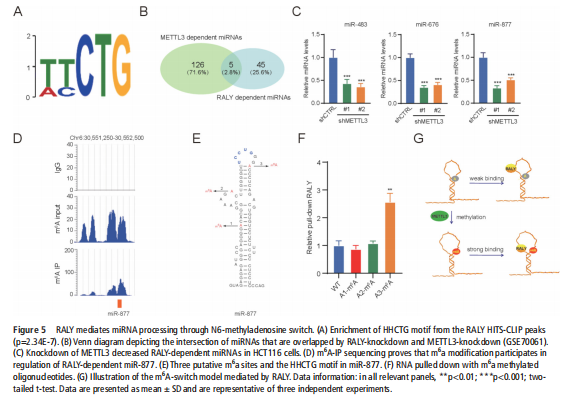
(图五)
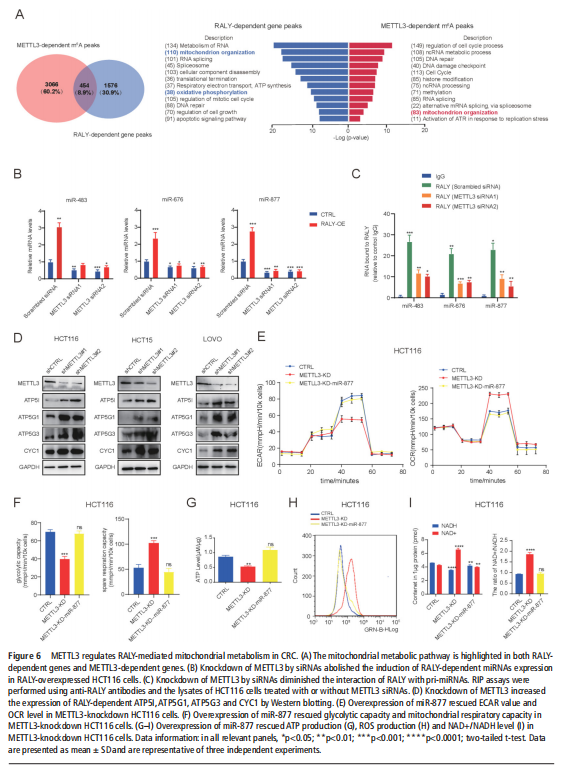
(图六)
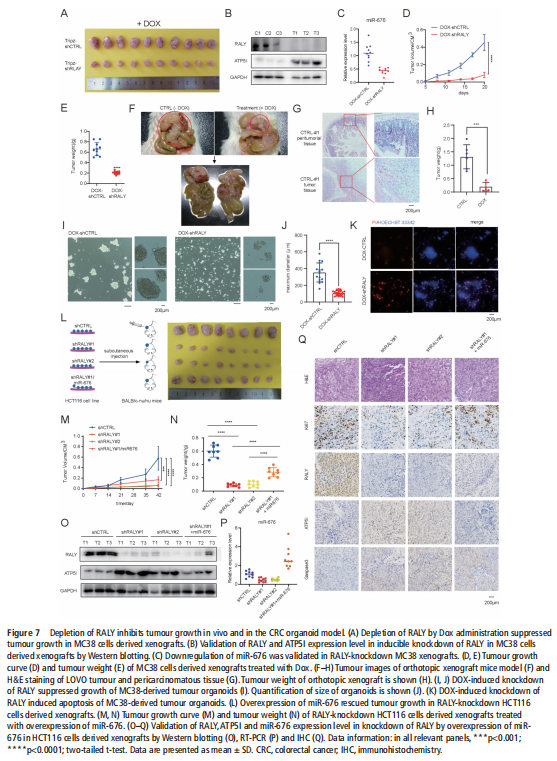
(图七)
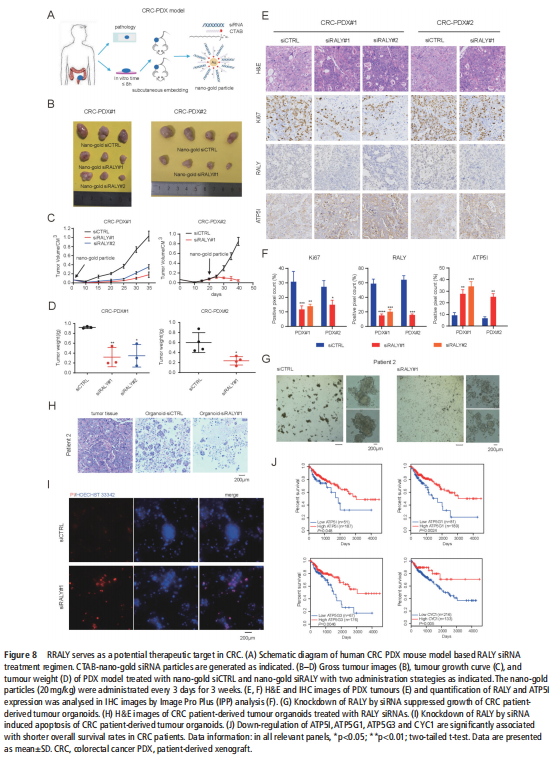
(图八)
结论
对全基因组miRNA表达谱的系统分析表明,miRNA表达异常有助于细胞转化和肿瘤进展。3637发现miRNA的茎-环结构对Drosha介导的切割至关重要。当前的研究,包括本研究,已经表明RNA结合蛋白赋予了招募和处理个体miRNAs的特异性。从Drosha微处理器复合体中鉴定出的RNA结合蛋白越来越多,其中包括异质核核糖核蛋白家族成员,包括hnRNPA1、hnRNPA2B1、hnRNPK和hnRNPL。在本研究中,确定了hnRNP的一个新成员RALY,该成员与CRC分期和侵袭性高度相关,与Drosha复合体相互作用,并促进miR-483、miR-676和miR-877等miRNAs亚群的表达。此前,有报告称miR-483参与了多种癌症的发生和侵袭。作者发现,这些依赖RALY的miRNAs下调了ETC基因、ATP5I、ATP5G1、ATP5G3和CYC1,并介导了CRC细胞中线粒体代谢的重编程,这为表观遗传调控和线粒体代谢之间的联系提供了功能性联系。本文的结果表明,在CRC细胞中,对RALY的抑制会破坏ATP的产生,诱导ROS水平并增加NAD+/NADH比率,而在RALY耗竭的细胞中过度表达miR-483、miR-676和miR-877可挽救代谢现象类型。我们在RALY缺失的细胞中进一步敲除了相关的ETC基因,并证实了RALY在OXPHOS中的代谢中枢效应主要是由这些ETC基因介导的(见图九)
本研究实验结果揭示了RALY在肿瘤进展中以代谢为中心的关键作用,这可能会导致针对RALY的癌症疗法用于治疗CRC。总之,本研究不仅揭示了RALY在m6A开关介导的OXPHOS重编程中以代谢为中心的关键作用,还强调了CRC的一个潜在治疗靶点。
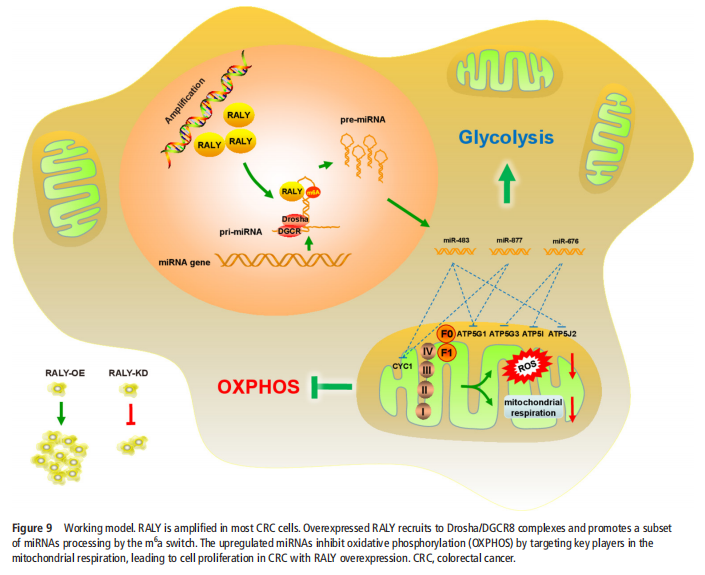
(图九)
文章出自:细胞实验 想了解更多请关注:http://www.do-gene.com/




