
介绍
肺癌是影响男性和女性的最致命的癌症之一。在过去的50年中,肺癌的发病率和死亡率都得到了显着改善,但是对于这种疾病,需要更优化的治疗和结果。大约85%的肺癌患者属于非小细胞肺癌(NSCLC)组织学亚型。化疗是肺癌的主要治疗方法,铂类双重治疗是晚期患者的标准治疗方法。然而,临床耐药性仍然是一个挑战,极大地阻碍了治疗的成功。因此,有必要更全面地了解耐药性机制,以充分对抗这种疾病。
一些研究报告称,外泌体在肺癌的肿瘤发生中起着至关重要的作用。外泌体,由晚期内体产生的膜结合囊泡,含有不同的生物分子,通过在微环境中充当信使来影响细胞功能。最近的一项研究表明,通过外泌体递送EphA2蛋白增强了胰腺癌中的吉西他滨耐药性。因此,外泌体可能通过将生物分子直接转移到细胞或通过改变微环境来影响细胞功能。
缺氧是在大多数恶性肿瘤中观察到的常见现象,与耐药性和肿瘤发生有关。当肿瘤血管的不规则或距离导致氧气供应不足时,就会发生肿瘤发生缺氧。为了应对缺氧,癌细胞通过各种细胞机制适应缺氧环境,使它们能够存活。缺氧环境中发生的一个重要变化是葡萄糖代谢的改变,即从氧化磷酸化转变为糖酵解以满足肿瘤细胞的能量需求。肿瘤代谢的重编程,称为Warburg效应,被认为是癌症的标志PKM2是Warburg效应的重要调节剂,它催化磷酸烯醇式丙酮酸(PEP)合成丙酮酸以促进无氧糖酵解,从而使肿瘤细胞茁壮成长。PKM2有利于癌症进展的观点是,它充当HIF-1α的转录共激活剂,并在缺氧条件下调节癌细胞的代谢重编程。另一项研究表明,组蛋白H3在EGF受体激活后被PKM2磷酸化,这对于肿瘤发生和促进基因转录至关重要。这些研究表明PKM2不仅在有氧糖酵解中起作用,而且还调节基因转录。
缺氧在实体瘤中很常见,会导致DNA损伤药物的耐药性。然而,这种抵抗背后的机制仍不清楚。在本研究中,作者旨在探讨缺氧诱导的外泌体对非小细胞肺癌(NSCLC)的影响。
方法与结果:
本研究通过将NSCLC细胞置于常氧或缺氧条件下以评估细胞存活率和关键蛋白表达水平的变化。进行比较蛋白质组学以鉴定常氧或缺氧顺铂耐药性NSCLC细胞衍生的外泌体中的外泌体PKM2。体外和体内实验评估了缺氧诱导的外泌体PKM2在促进NSCLC细胞顺铂耐药中的作用,并进行一系列检查证明了缺氧诱导的外泌体PKM2的分子机制。进行了一系列体外实验以评估缺氧诱导的外泌体对癌症相关成纤维细胞(CAF)的作用。结果显示,由于在缺氧顺铂耐药细胞分泌的外泌体中观察到PKM2表达增加(见图二),缺氧加剧了肺癌细胞的顺铂耐药(见图一)。作者发现缺氧诱导的外泌体PKM2(见图三)在体外和体内将顺铂耐药性传递给敏感的NSCLC细胞(见图四)。从机制上讲,缺氧诱导的外泌体PKM2促进NSCLC细胞中的糖酵解产生还原性代谢物,这可能会中和顺铂诱导的活性氧(ROS)。此外,缺氧诱导的外泌体PKM2以PKM2-BCL2依赖性方式抑制细胞凋亡(见图五)。此外,缺氧诱导的外泌体PKM2重编程CAFs以创造促进NSCLC细胞增殖和顺铂耐药的酸性微环境(见图六、图七)。
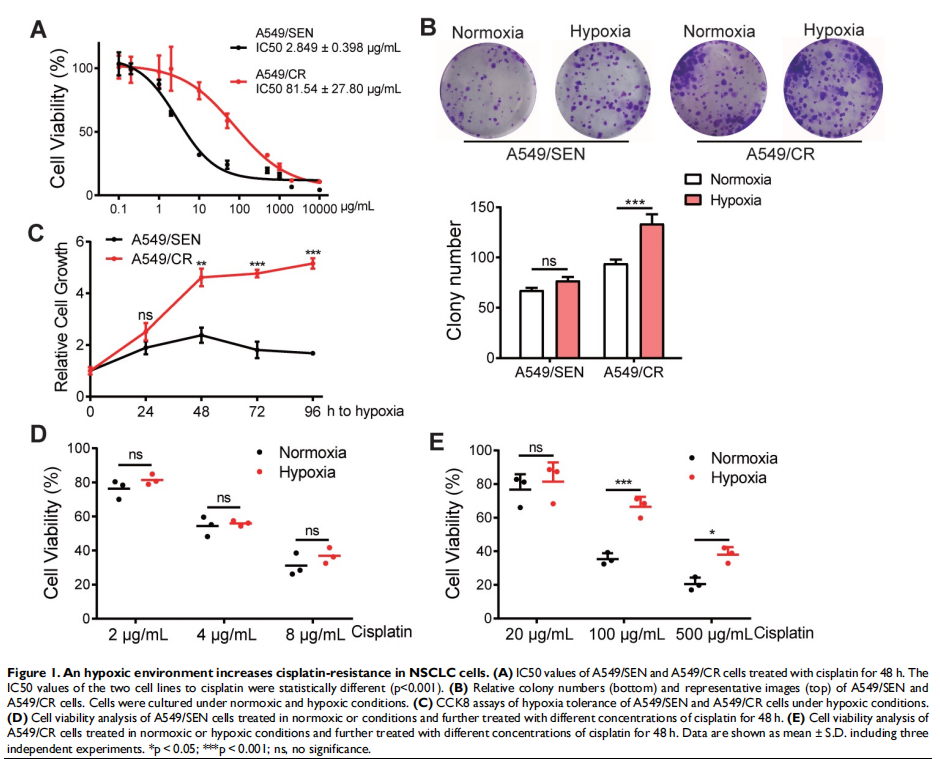
(图一)
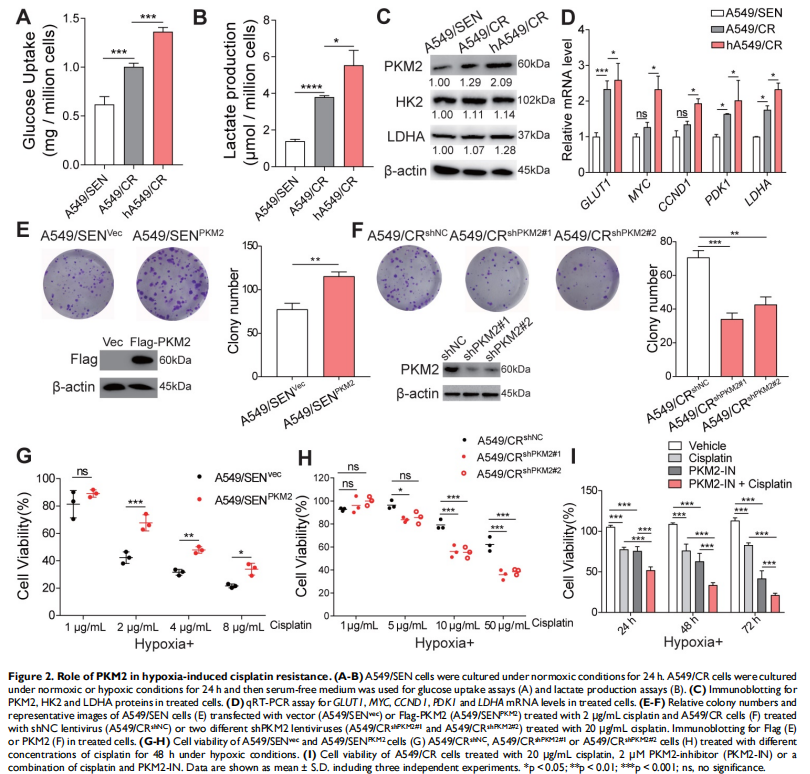
(图二)
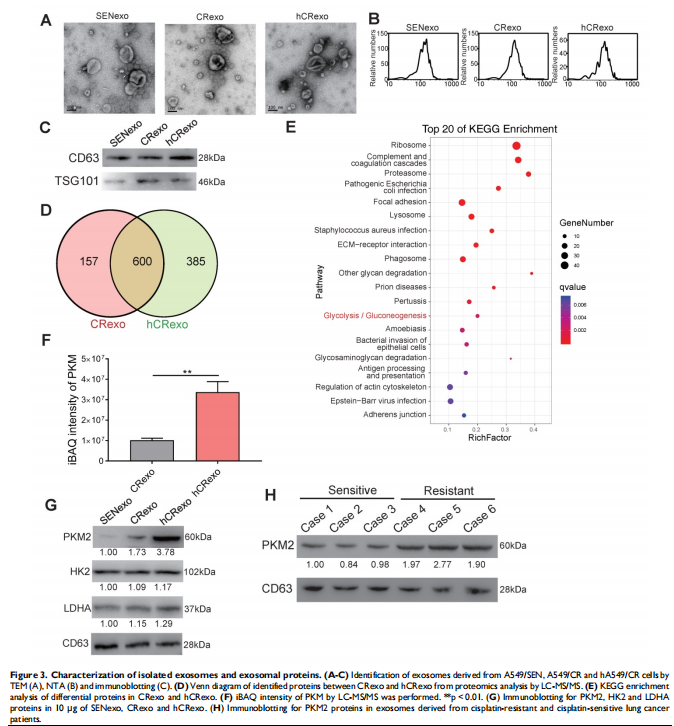
(图三)
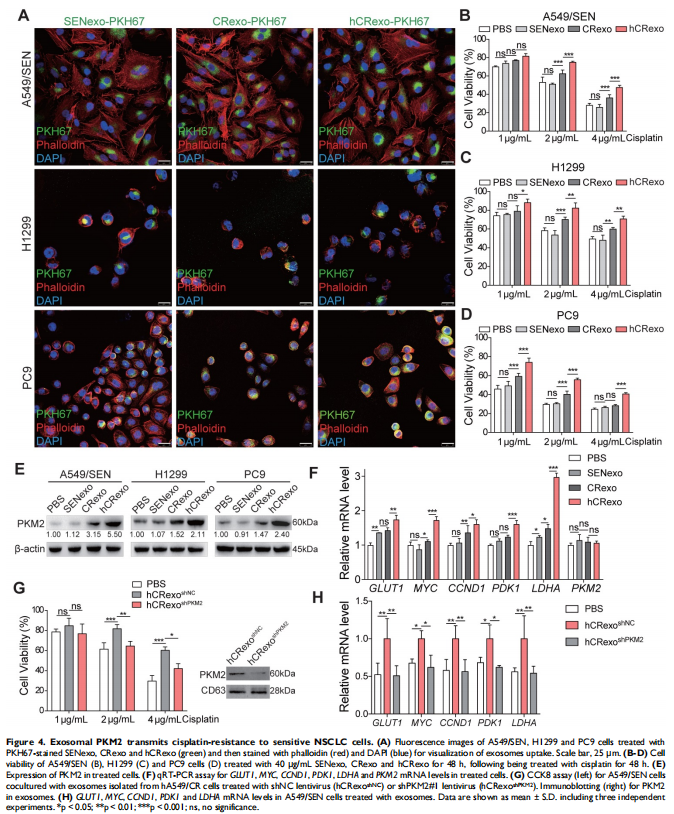
(图四)
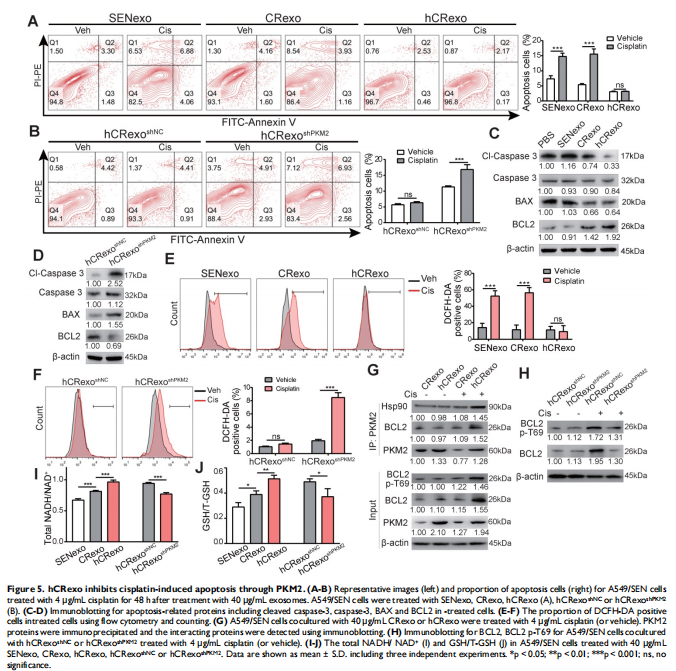
(图五)
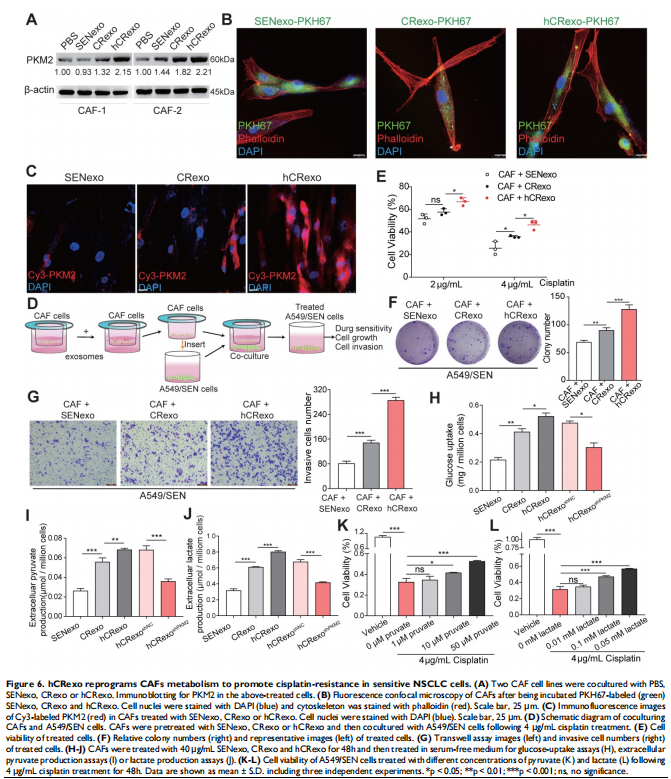
(图六)
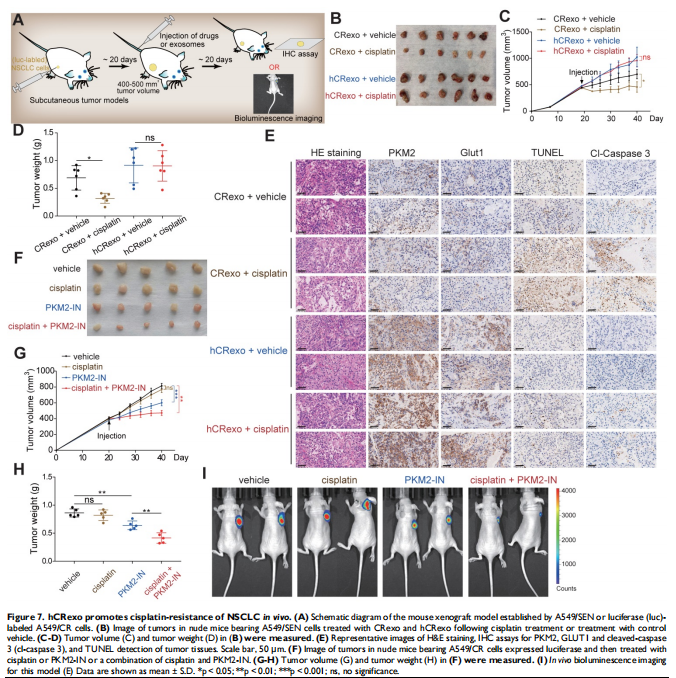
(图七)
结论:
在这项研究中,我们揭示了外泌体 PKM2 传递NSCLC化疗耐药性及其机制。肿瘤内部的缺氧区域通常对化疗耐药,这些缺氧耐药细胞通过两种方式传递耐药性(见图八)。总体而言,这项研究提出了实体瘤中耐药性传播的新机制。缺氧诱导的外泌体通过PKM2依赖性机制和通过重新编程CAF以创造耐药性微环境直接传递耐药性。外泌体PKM2可能是临床检测顺铂耐药NSCLC的潜在生物标志物,这将使患者能够接受PKM2的靶向治疗。
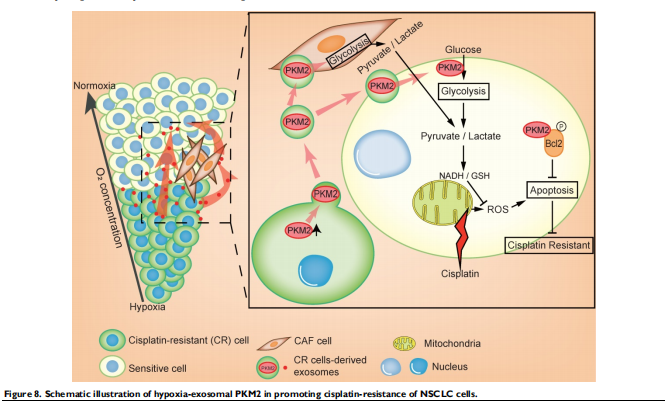
(图八)




