摘要:MicroRNA(mirna)是一类小的非编码RNA,通过与细胞转录物结合来调节基因表达,从而导致翻译抑制或靶mRNA降解。Dicer和Drosha是miRNA成熟所需的miRNA加工酶。在此,本文研究了Dicer和Drosha在血管生成中的作用。用siRNA转染内皮细胞对抗Dicer和Drosha,以抑制miRNA的生物合成。Dicer和Drosha的遗传沉默显著降低了内皮细胞的毛细血管萌发和成管活性。在Dicer siRNA转染的细胞中,内皮细胞的迁移显著减少,而Drosha siRNA没有影响。Dicer(而非Drosha)沉默会降低体内血管生成。接下来,又尝试鉴定在内皮细胞中表达的miRNAs。使用实时PCR对168种人miRNAs进行的筛选分析显示,let-7家族成员mir-21、mir-126、mir-221和mir-222在内皮细胞中高度表达。Dicer和Drosha siRNA降低了lef-7f和mir-27b的表达。针对let-7f和mir-27b的抑制剂也减少了芽的形成,表明let-7f和mir-27b通过靶向抗血管生成基因促进血管生成。对let-7簇的预测靶的计算机分析鉴定了内源性血管生成抑制剂血小板反应蛋白-1.实际上,Dicer和Drosha siRNA显著增加了血小板反应蛋白-1的表达。总之,miRNA调节酶Dicer的瞬时减少会损害体外和体内血管生成,而Drosha siRNA在体外诱导了轻微的抗血管生成作用,但在体内无效。let-7家族和mir-27b似乎是调节血管生成的有吸引力的靶点。

研究背景
MicroRNAs(miRNAs)是一类新型的高度保守的非编码小RNA,通过与转录本结合,在转录后水平上调控基因表达,导致靶mRNA的翻译抑制或降解。越来越多的证据表明,miRNAs参与了各种生物过程,如心脏发生、骨骼肌增殖和分化、大脑形态发生、肿瘤发生和造血谱系分化。
miRNAs是由两种主要酶Dicer和Drosha介导的两步处理途径中产生的,它们属于RNAseIII内切酶类。虽然Drosha在体内的功能目前尚不清楚,但Dicer在脊椎动物的发育中起着至关重要的作用。双基因缺陷小鼠在胚胎发育早期死亡,在胚胎第12.5-14.5天之间,显示血管和卵黄囊形成受损。斑马鱼Dicer突变胚胎在原肠形成、大脑形成、体细胞发生和心脏发育过程中表现出异常的形态发生。最近的一项研究表明,mir-221和mir-222调节人脐静脉内皮细胞的血管生成特性(HUVECs)。然而,miRNAs在内皮细胞生物学中的功能尚不清楚。因此,本文主要研究mirna调节酶Dicer和Drosha在内皮细胞血管生成功能中的作用。研究结果表明,Dicer和Drosha在体外是内皮芽和网络形成的关键调控因子,而只有DicersiRNA在体内显著阻断了血管生成。
方法与结果
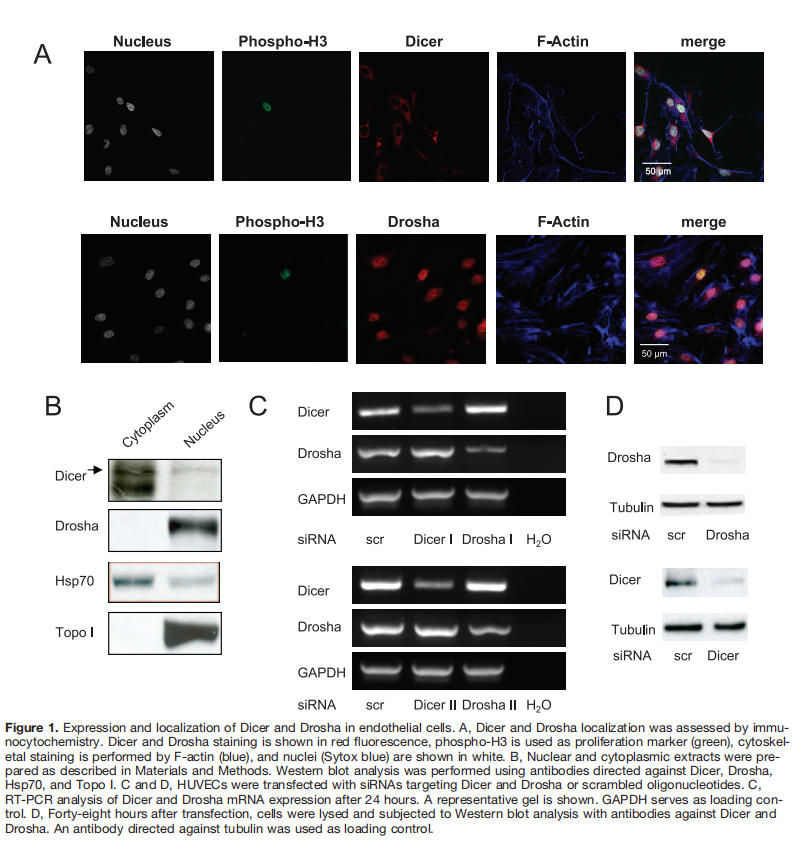
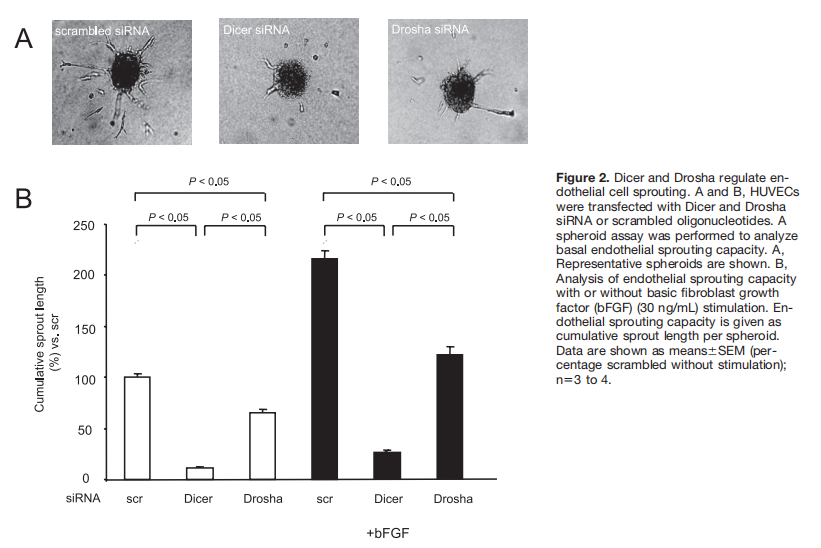
首先使用免疫细胞化学和Western blot分析评估了这两种酶的表达和定位。Dicer主要定位于细胞质,而Drosha的定位仅限于内皮细胞核(图1A和1B)。siRNA法测定Dicer和Drosha表达沉默后的内皮发芽和网络形成(图1C和1D)。Western blotting证实各自的siRNA寡核苷酸对Dicer和Drosha的有效和特异性抑制(图1D)。Dicer和Drosha的减少显著抑制了基础和碱性成纤维细胞生长因子刺激的内皮细胞芽形成(图2A和2B),而VEGF诱导的芽形成被Dicer siRNA选择性阻断(在线数据补充资料中的图I,可查阅http://circres.ahajournals.org)。然而,与Dicer或Drosha基因表达的单次降低相比,未检测到相加效应(补充图IIA和IIB)。作为Dicer和Drosha沉默特异性的对照,产生了第二个Dicer和Drosha siRNA,与Dicer和Drosha siRNA I相比,其减少毛细血管芽形成的程度相似。


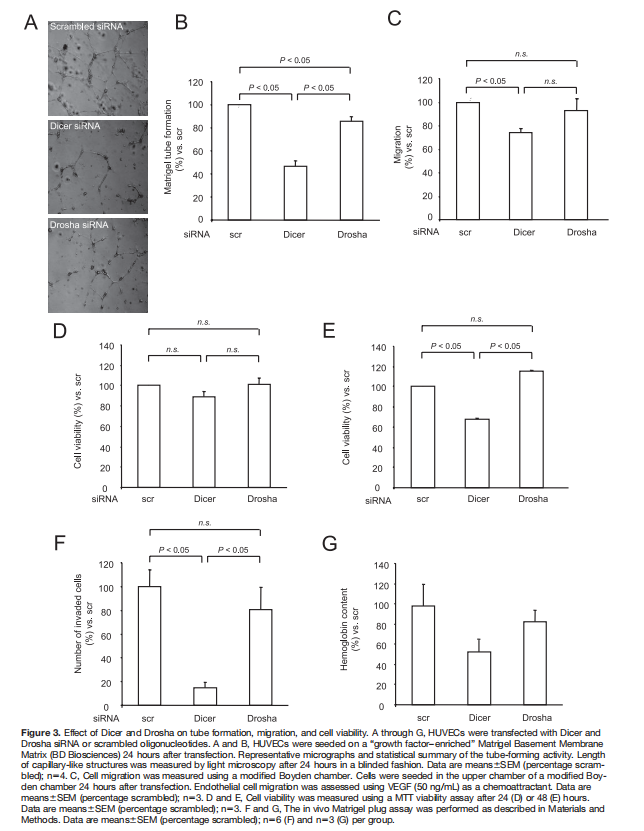
此外,使用Matrigel分析法,对Dicer和Drosha的抑制导致网络形成活性显著受损(图3A和3B)。又进一步进行了Boyden小室迁移试验。虽然Dicer siRNA介导的敲除显著降低了迁移能力,但Drosha敲除对细胞迁移没有影响(图3C)。为检测内皮细胞发芽和管形成的减少是否继发于对细胞生长或凋亡的非特异性影响,使用MTT法测定了细胞存活率。如图3D所示,24小时后,Dicer和Drosha敲除并未损害细胞活力。48小时后,Dicer siRNA转染轻微降低了存活率,而Drosha siRNA转染不影响存活率(图3E)。接下来,又评估了Dicer对体内血管生成的影响。由于Dicer缺陷小鼠是胚胎致死性的,因此无法用于本研究,将siRNA转染的人脐静脉内皮细胞以Matrigel栓塞的形式皮下注射到裸鼠中,并评估了芽的形成。使用Dicer的Matrigel栓塞中,血管样结构显著减少siRNA-转染的人脐静脉内皮细胞(图3F)。Dicer沉默还会降低Matrigel栓塞血红蛋白浓度,表明血液供应减少(图3G)。相比之下,Drosha siRNA转染并未显著影响Matrigel栓塞体内的发芽血管生成和血红蛋白浓度(图3F和3G)。
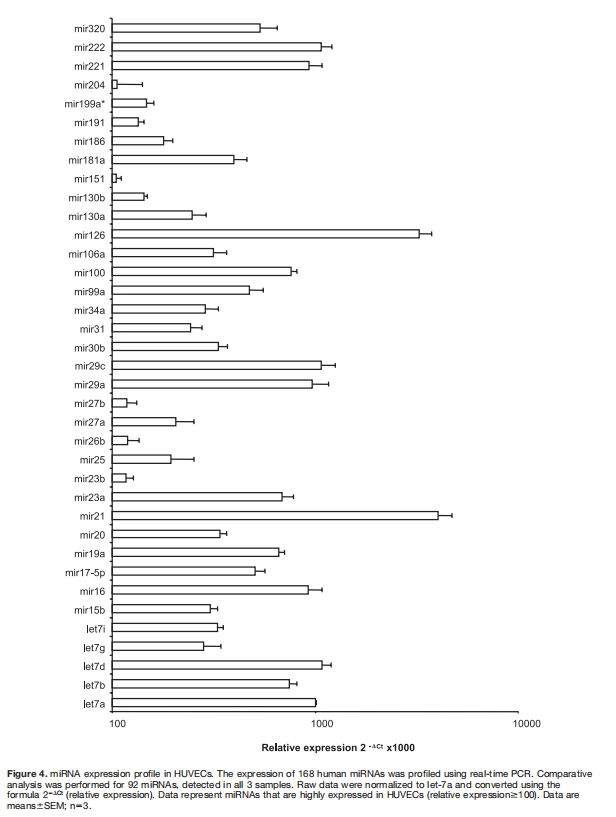
为了评估mirna在内皮细胞功能中的特异性参与,研究人员分析了168种人mirna在人脐静脉内皮细胞中的表达。相对表达(2Ct)为100的miRNAs如图4所示,特别是,miR-21、miR-126、mir-221和mir-222在内皮细胞中高表达。此外,let-7家族的一些成员发现了人脐静脉内皮细胞的高丰度。为了研究Dicer和Drosha在内皮细胞miRNA表达中的作用,我们使用miRNA阵列分析了344种人miRNA在siRNA靶向Dicer和Drosha敲除后的表达(图5和表)。202个miRNAs的表达低于检测的检测极限。对Dicer和Drosha下调效应的选择性分析显示,通过Dicer敲除,2个mirna的表达降低至30%以上,通过Drosha敲除,29个mirna降低至30%以上,31个mirna受两种酶调节。通过mir-27b和let-7f的RT-PCR证实了Dicer和Drosha敲除后miRNA表达的减少(图6A和6B)。为检测mir-27b和let-7f的功能效应,使用特异性抑制剂阻断miRNA。对mir-27b和let-7f的抑制显著降低了体外芽形成(图6C)。

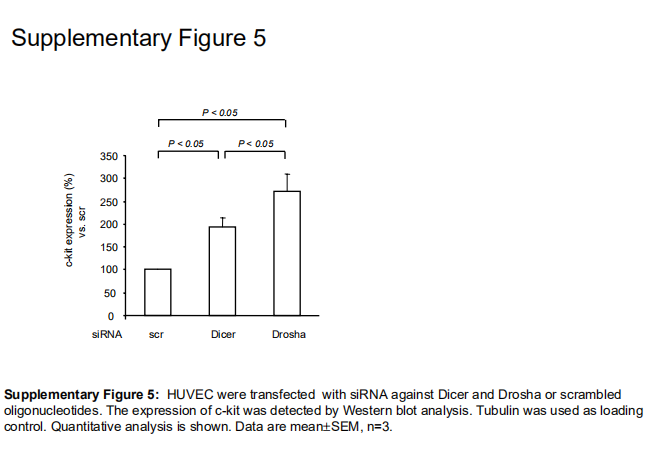

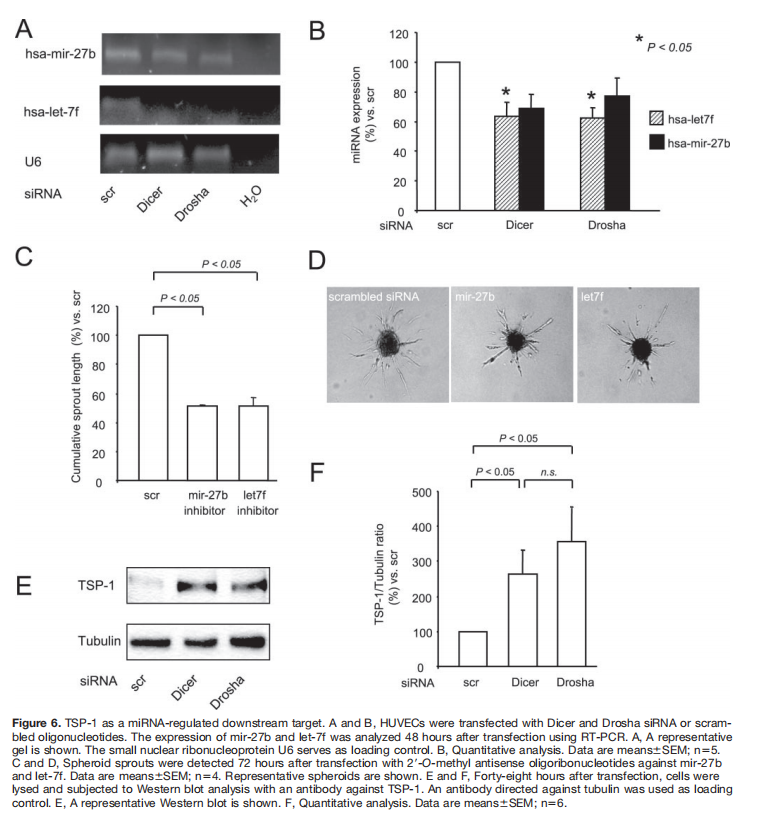
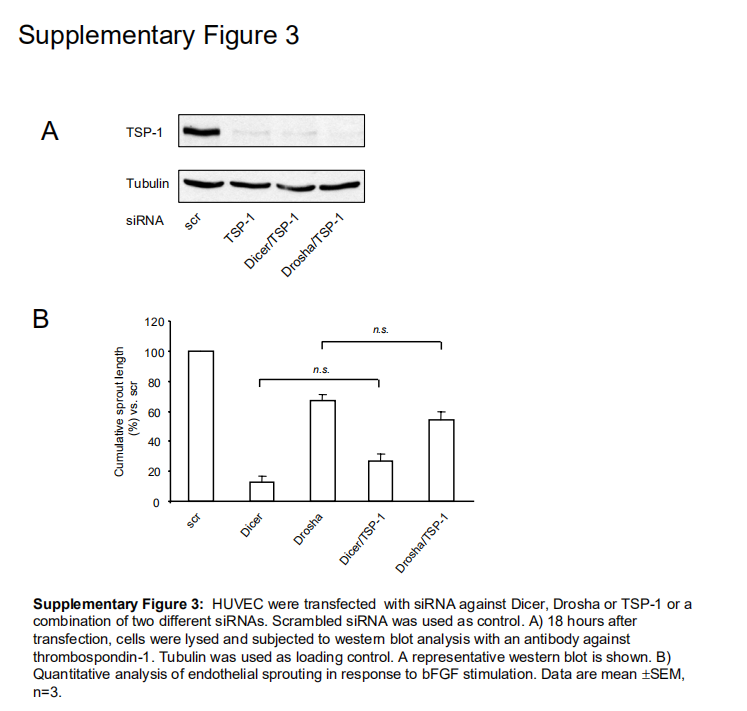
使用miRanda软件对潜在靶基因进行的计算机预测显示,let-7 miRNA家族可能调节TSP-1的表达,TSP-1最近被鉴定为内源性血管生成抑制剂。因此,评估了Dicer和Drosha siRNA转染后TSP-1的表达。如图6D和6E所示,通过siRNA转染减少Dicer和Drosha,在Dicer siRNA转染细胞中TSP-1的表达显著增加到26368%,在Drosha siRNA转染细胞中分别增加到35895%。然而,siRNA对TSP-1表达的耗竭并未挽救由Dicer或Drosha缺乏诱导的受损芽形成(补充图III),表明涉及额外的靶点以充分解释血管生成抑制。因为与其他let-7家族成员相比,let-7f受Dicer和Drosha的下调最深,所以我们研究了let-7f抑制剂对TSP-1表达的影响。然而,对let-7f的抑制仅导致TSP-1表达轻微(不显著)增加至11518% (n6),表明其他miRNAs参与了TSP-1的调节。
Dicer和Drosha沉默对细胞因子表达和Akt信号通路的影响
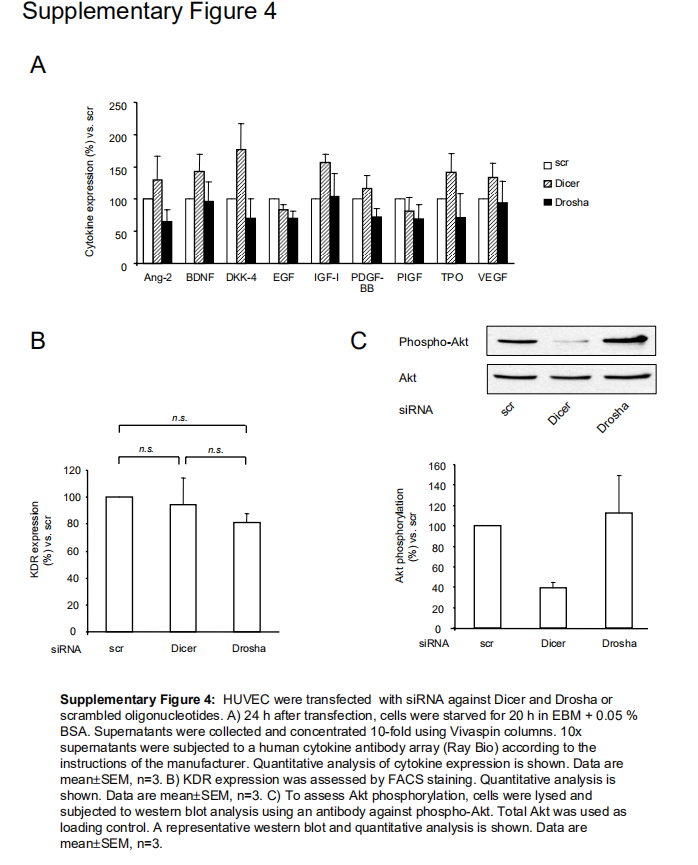
最后,再次使用人细胞因子阵列阐明了Dicer和Drosha对血管生成生长因子表达的影响。尽管Dicer siRNA显著抑制血管生成,但Dicer沉默的内皮细胞中大多数促血管生成细胞因子均增加(补充图IVA)。此外,未检测到VEGF受体2表达的显著差异(补充图IVB)。相反,与Drosha siRNA处理的细胞相比,在Dicer siRNA中Akt磷酸化被选择性抑制(补充图IVC),表明Dicer干扰了Akt活化。
讨论
本研究证明了Dicer和Drosha在体外参与血管生成的调节。Dicer表达沉默还会损害体内血管生成,而Drosha耗竭未产生显著影响。对内皮细胞中高表达miRNA的分析提供了证据,表明miRNA let-7f和hsa-mir-27b受到Drosha和Dicer siRNA的显著下调。根据推测的let-7靶点的计算机预测,我们的数据表明Dicer和Drosha通过let-7家族成员调节血管生成抑制剂TSP-1。
总之,我们的数据为Dicer和Drosha对内皮细胞功能的重要作用提供了证据。双角缺陷内皮细胞体外血管生成的严重损害与最近在目前修订期间发表的研究结果一致。Dicer和Drosha下调的血管生成抑制作用可能部分与血管生成抑制剂TSP-1的增强有关。然而,Dicer和Drosha沉默细胞之间的深刻差异更有可能归因于Dicersirna处理的细胞中Akt信号的选择性损伤。由于多种miRNA被Drosha和/或DicersiRNA高表达和失调,并且每个miRNA都有多个促血管生成和抗血管生成靶点,因此需要进一步的研究来分析血管生成过程中基因表达转录后调控的复杂过程。
文章出自:细胞实验外包 想了解更多请关注:http://www.do-gene.com




