摘要:
胶质瘤起始细胞(GIC)的表型受细胞内在和细胞外部因素的调节。GIC的表型异质性和可塑性是对靶向癌症干细胞的治疗方法的一个重要限制。可塑性也对纯化的癌症干细胞的鉴定、分离和繁殖提出了挑战。在这里,作者使用GIC的条形码标记方法在数代中产生克隆群体,并结合已建立的干细胞标记CD133、CD15、CD44和A2B5进行表型分析。利用来自异柠檬酸脱氢酶(IDH)-野生型胶质母细胞瘤的两种细胞系,作者发现了两种细胞系之间表型的显著异质性。在传代过程中,克隆的扩增表现为条形码克隆数量有限的出现和克隆总数的减少。双标记的GIC能够形成可追踪的克隆群体,这些群体在混合培养的两代后就会出现,通过对16个表面标记的相对比例的相似性分析,我们能够确定这些群体的命运。通过产生肿瘤类器官,作者观察到显性克隆显著存在,但干标记表达也具有显著的可塑性。本研究提出了一种同时进行条形码和表型胶质瘤起始细胞的实验方法,以评估其功能特性,例如筛选新建立的GIC的肿瘤特异性治疗脆弱性。

介绍
胶质母细胞瘤起始细胞(GIC)可以重建肿瘤间和肿瘤内癌症干细胞(CSC)异质性的各个方面。细胞特性可以通过细胞内在因素(如遗传、表观遗传和代谢因素)进行调节,并通过由微环境、利基因素和宿主免疫系统创建的细胞外在因素进一步多样化。肿瘤体积内的遗传异质性可以通过选择压力(如治疗)演变,有利于出现具有抗药性的克隆。对表型异质性理解的进展挑战了将CSC分化定义为单向和不可逆层次结构的定义。这种可塑性是了解肿瘤发病机制的关键,其中表型转变可能发生在治疗耐药性发展过程中的起始、进展和克隆选择过程中。
肿瘤块中的一部分细胞被认为具有CSC特性,即具有驱动肿瘤生长的潜力,但在没有允许的环境的情况下它们可能不会这样做,或者它们可能被免疫细胞或免疫细胞等外在因素杀死。许多标志物与CSC的干性特性相关,其中CD133、CD15、CD44和A2B5应用最为广泛。多项研究已经证明了将这些表面标志物组合起来以表征功能不同的胶质母细胞瘤干细胞群的效用,但同时人们认识到这些标志物可以通过改变来调节微环境。最近的一项研究使用标记CD133、CD44、CD15和A2B5来表征GBM肿瘤内异质性并显示这些干性标记表达的惊人可塑性。
为了解决表面标记异质性(表型)和克隆性之间的关系,这是在GBM中尚未广泛研究的一个方面,作者结合了GIC(增强型蓝色荧光蛋白(EBFP)2、T-Sapphire、Venus和mOrange),同时捕获其CD133、CD44、CD15和A2B5的表面标记谱。克隆动力学中理解异质性的重要性,被认为是GIC做出的命运决定的结果,之前已提出35.我们使用这种组合方法来研究在贴壁培养和更复杂的三维类器官培养中体外繁殖期间克隆群体的表型可塑性,以便更好地了解细胞群体的可塑性是否归因于表面标记表达的改变。相对稳定的GIC基因定义(条形码)群体,或异源起始群体的差异扩张。这种理解对于开发有助于系统地表征新从患者材料中提取的GIC的分析方法非常重要。
方法与结果
本研究通过使用慢病毒介导的荧光团表达来标记细胞。研究结果显示:4个荧光团的组合产生6个双标记(条形码)群体(见图一);通过条形码标记在培养物中生成多个不同的克隆(见图二);平行传播过程中混合条形码细胞中的表面标记表型揭示了不同神经胶质瘤细胞系的不同特性(见图三);对克隆一致性的分析揭示了跨文化和传代的表型变化(见图四);微环境改变了肿瘤类器官中克隆种群的空间组织(见图五)。

(图一)
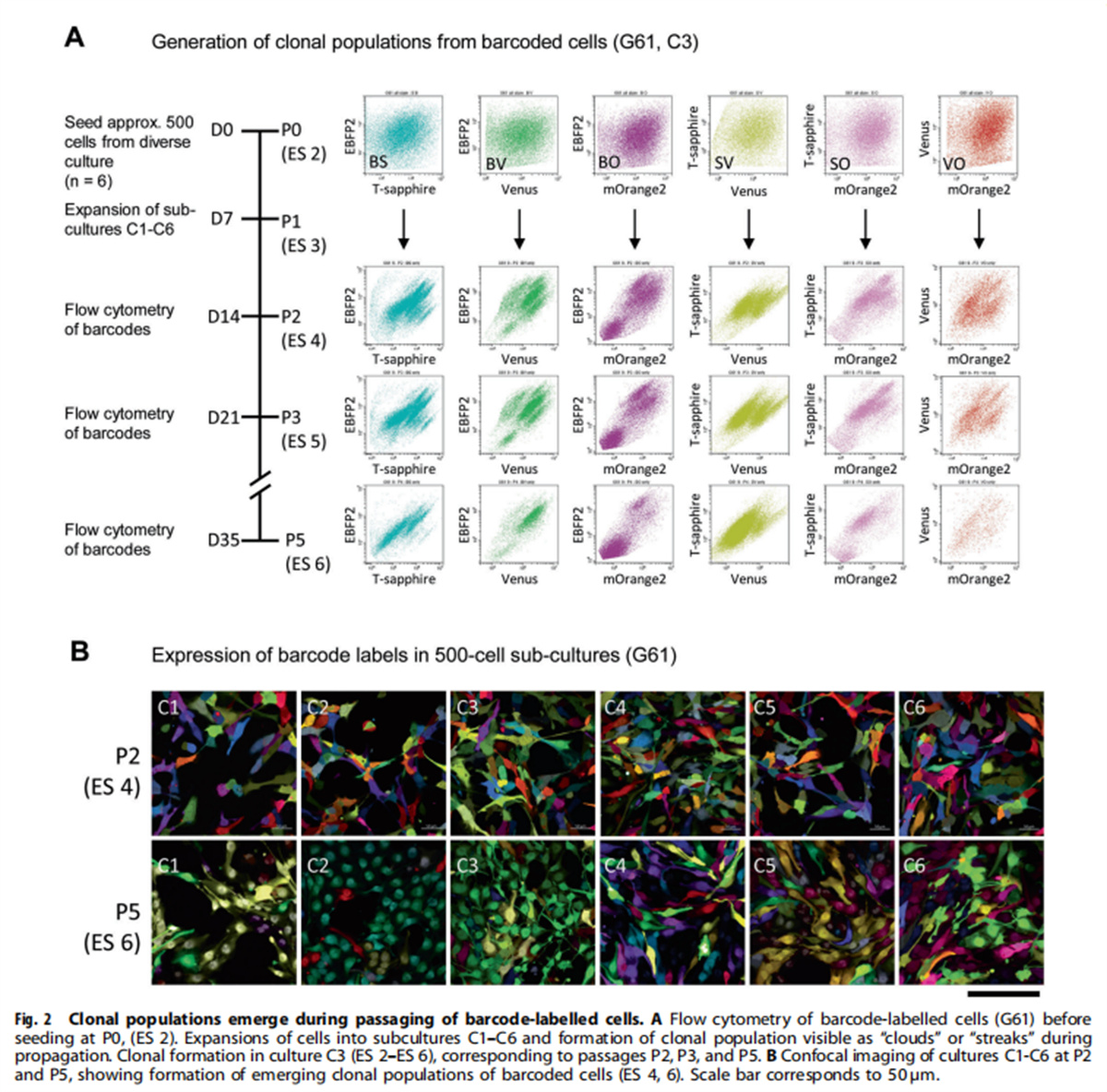
(图二)
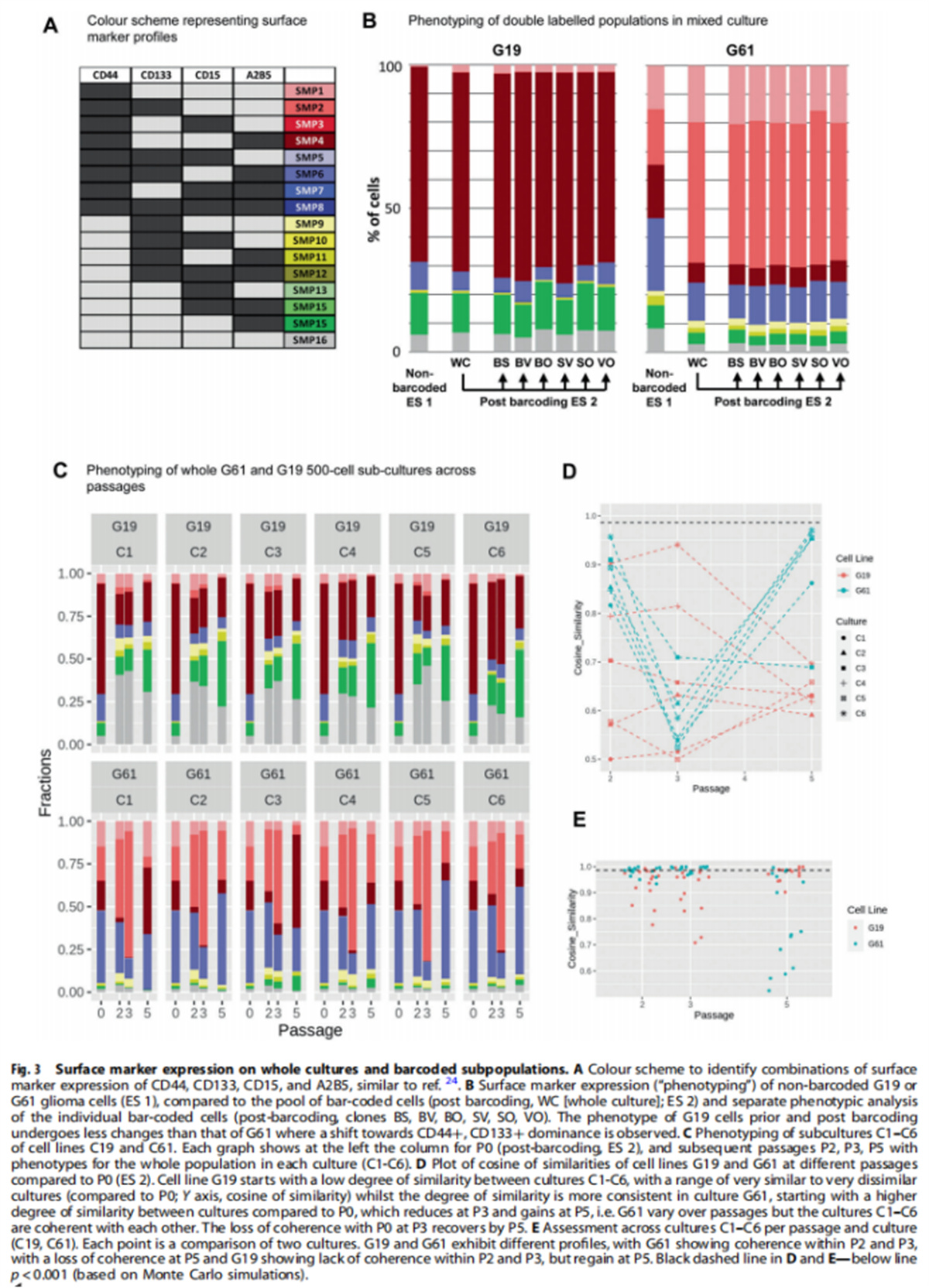
(图三)
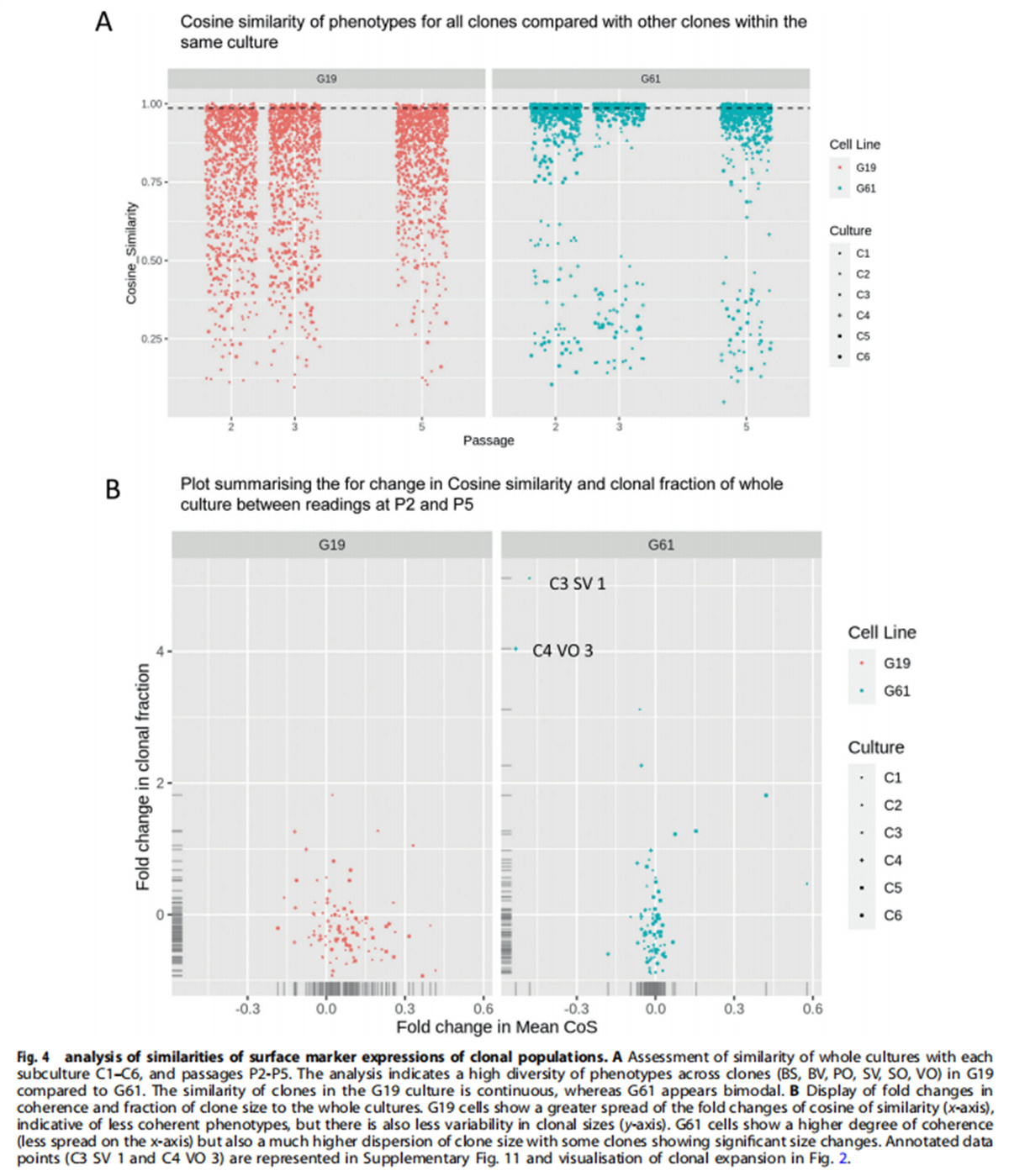
(图四)
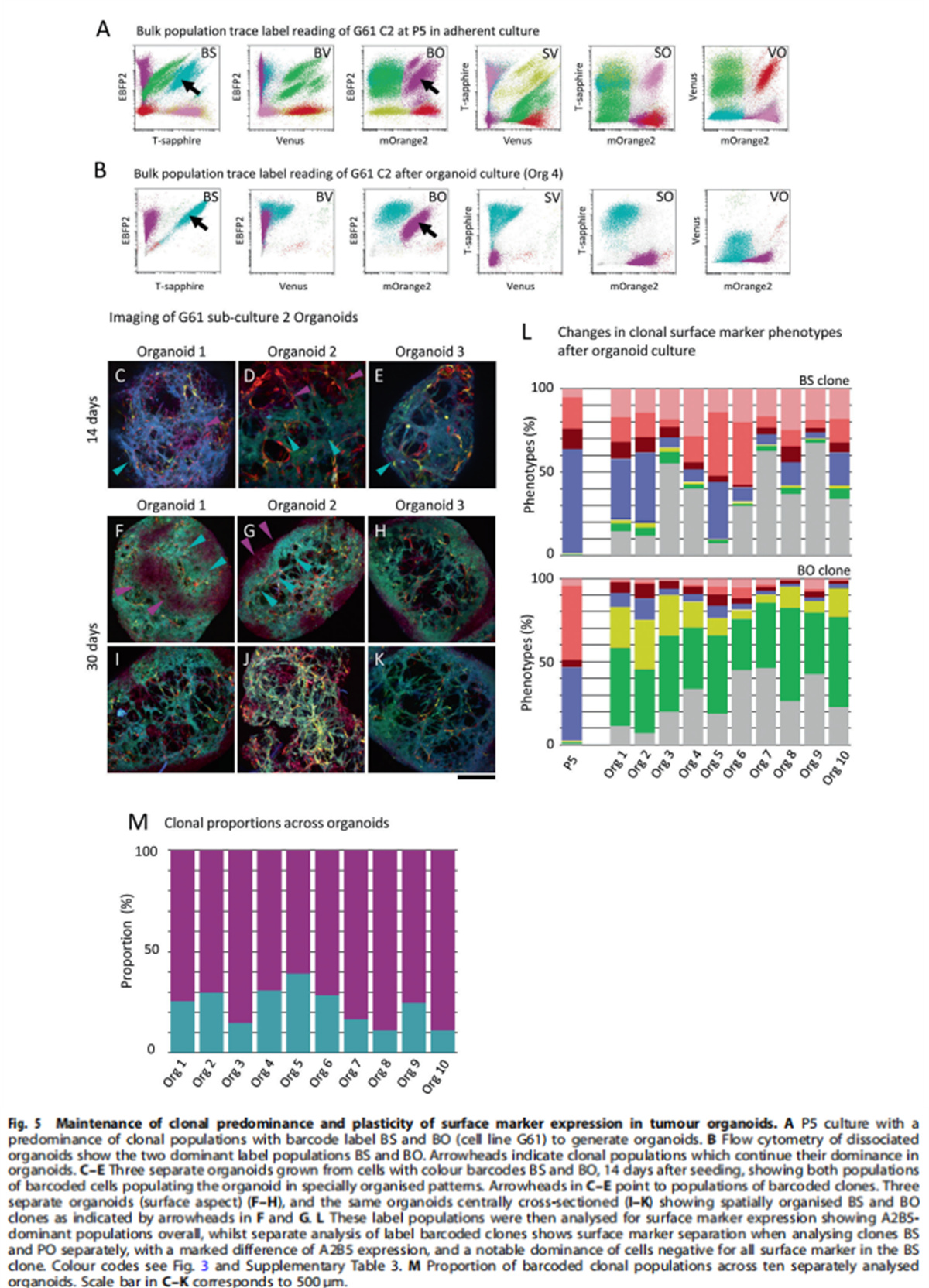
(图五)
结论
总之,作者在这里提出了一种对胶质瘤起始细胞进行条形码化并创建克隆群体的实验方法,这些克隆群体可以同时进行表型分析。通过计算分析,我们能够查明这些群体的命运,这可用于询问表型可塑性以响应不断变化的肿瘤环境。克隆选择工作流程的简化,结合可重复和可靠的读数来评估GIC的功能特性,使得该检测可能非常适合筛选新建立的GIC的肿瘤特异性治疗漏洞,并评估实验性遗传或表观遗传的影响修改。
文章出自:细胞实验外包 想了解更多请关注:http://www.do-gene.com/




