摘要:
诱导细胞凋亡是消除肿瘤细胞、改善癌症治疗的一种直接途径。细胞凋亡受到促凋亡和抗凋亡的Bcl-2蛋白平衡的严格控制。硼烷模拟物可以中和Bcl-2蛋白的抗凋亡功能,是诱导包括儿童恶性肿瘤在内的多种癌症实体凋亡的非常有前途的化合物。然而,硼烷模拟物在实体肿瘤中的临床应用受到对高浓度硼烷模拟物的频繁耐药性和高浓度或联合治疗的预期毒性的阻碍。增加硼烷模拟物效力的一个潜在途径是开发基于免疫细胞的治疗方法,以抵消肿瘤细胞固有的凋亡抗性,并使它们对免疫攻击敏感。在这里,我们描述了可以作为药物测试模型的儿童癌细胞的球状体培养。在这些3D模型中,我们能够证明激活的异体自然杀伤(NK)细胞迁移到肿瘤球状体中,并对广泛的儿童癌症球状体显示出细胞毒性,突出了它们作为抗肿瘤效应细胞的潜力。接下来,我们研究了用亚毒性浓度的硼烷模拟物治疗肿瘤球状体是否可以增加NK细胞的细胞毒性。值得注意的是,添加硼烷模拟物增强了NK细胞的细胞毒性作用。Bcl-XL抑制剂A1331852或Mcl-1抑制剂S63845均增加了NK细胞的细胞毒性,减少了球体大小,而Bcl-2抑制剂ABT-199对NK细胞介导的杀伤没有影响。综上所述,这是第一个描述靶向Bcl-XL或Mcl-1的硼烷模拟物与基于NK细胞的免疫治疗相结合的研究,突出了硼烷模拟物在免疫治疗中的潜力。

介绍
尽管儿童癌症的治疗取得了相当大的进展,但难治性疾病仍然与预后不良有关。在儿童最常见的颅外实体瘤形式中,神经母细胞瘤和横纹肌肉瘤(RMS)在高危患者群体中表现出特别差的结果,突出了改进治疗策略的必要性。
治疗癌症的一种方法是直接诱导肿瘤细胞凋亡。细胞凋亡可以通过细胞表面上死亡受体的连接来启动,或者通过细胞色素c的线粒体释放来启动,该细胞色素c由Bcl-2蛋白控制。虽然Bcl-2主要在淋巴恶性肿瘤中表达,但相关蛋白Bcl-XL和Mcl-1经常在包括儿科癌症在内的实体瘤中扩增和过表达。已经开发了几种结合和中和抗凋亡Bcl-2蛋白的化合物。因此,这些抑制剂以与仅BH3蛋白相似的方式拮抗抗凋亡Bcl-2蛋白,因此被称为BH3模拟物。使用ABT-199(venetoclax),第一个选择性抑制Bcl-2的BH3模拟物已获批准,并正在改变慢性淋巴细胞白血病等淋巴恶性肿瘤的治疗。Mcl-1和Bcl-XL的选择性和强效抑制剂也已确定,其中一些目前正在临床试验中进行研究。BH3模拟物靶向Bcl-XL的潜力多项研究强调了Mcl-1或Mcl-1在许多恶性肿瘤中的细胞凋亡诱导能力,无论是单独的还是相互结合的。
为了改进新型癌症治疗方案的转化,需要更好的癌症体外模型,更真实地反映疾病的特征和复杂性(例如,低氧微环境、药物外显率)。为此,已开发出3D球体或类器官培养物作为临床前癌症研究的有用工具。球体的生长是通过添加细胞外基质/支架成分和/或通过去除培养皿的粘附特性的培养方法来实现的,从而迫使细胞聚集。球体中的聚集和生长使细胞-细胞和细胞-基质相互作用,并允许对浸润性免疫细胞进行研究。
在这项研究中,本文研究了BH3模拟物是否可以作为NK细胞介导的癌细胞攻击的敏化剂。因此,我们假设BH3模拟物的亚毒性浓度可能足以引发癌细胞产生NK细胞介导的细胞毒性。为了概括BH3模拟物与NK细胞介导的杀伤的相互作用,我们使用了新的球体共培养模型。
方法与结果
本研究利用类器官技术为小儿癌症建立3D球体(见图一)。研究结果显示,BH3模拟物有效杀死肿瘤球体(见图二、图三、图四)。为了探索基于细胞系的球体是否可以作为药物测试平台,我们研究了对诱导凋亡的BH3模拟物的反应。实验结果进一步显示,肿瘤球体受到NK细胞的攻击(见图五);BH3模拟物和NK细胞的组合增加了对肿瘤细胞的杀伤力(见图六、图七)。
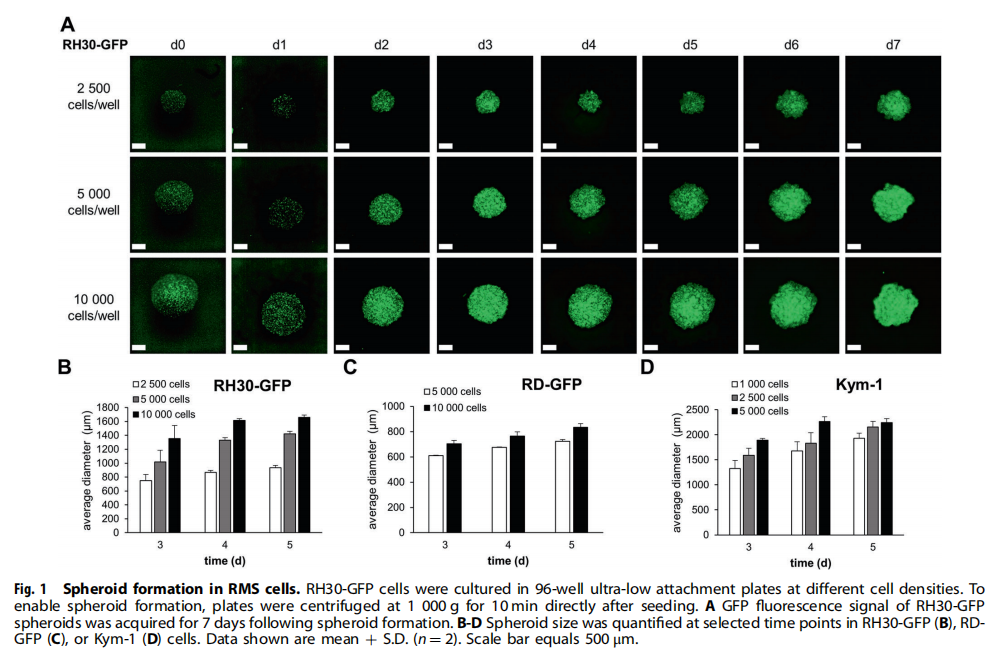
(图一)
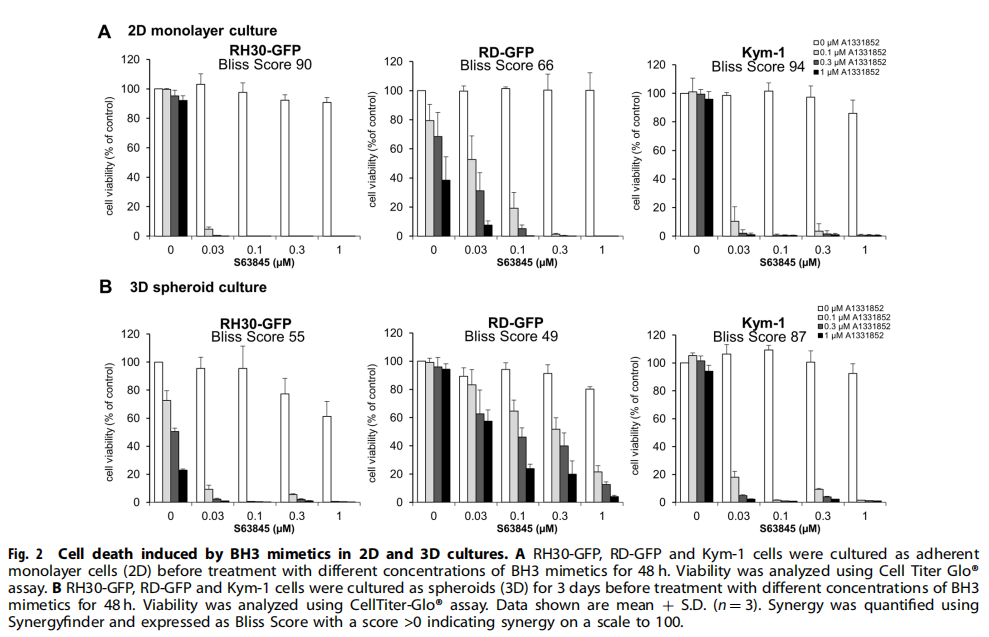
(图二)
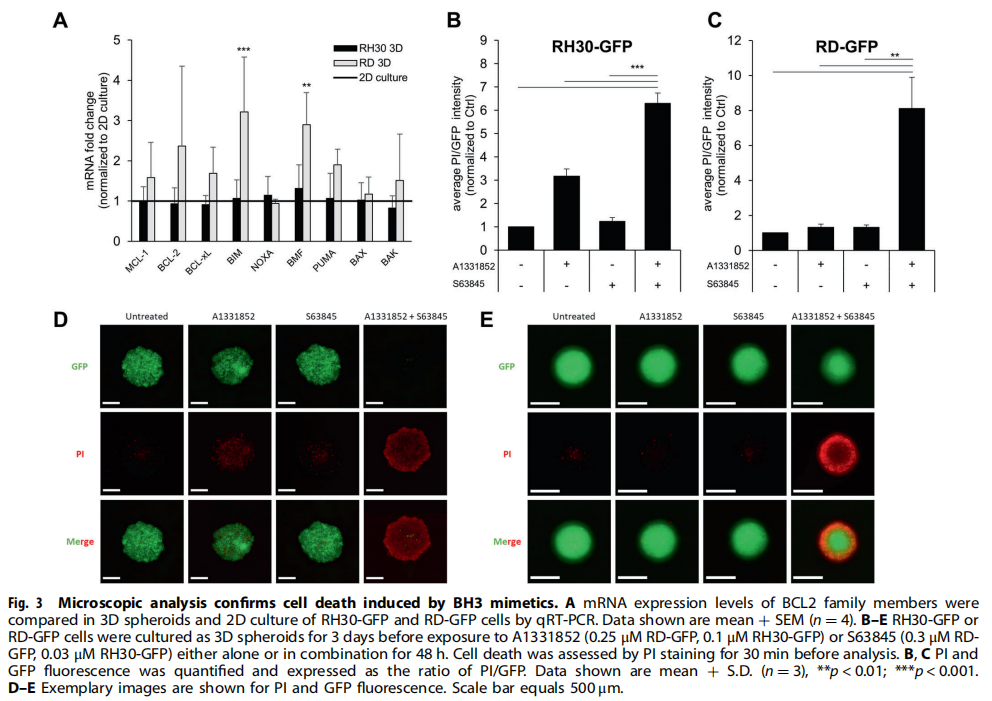
(图三)
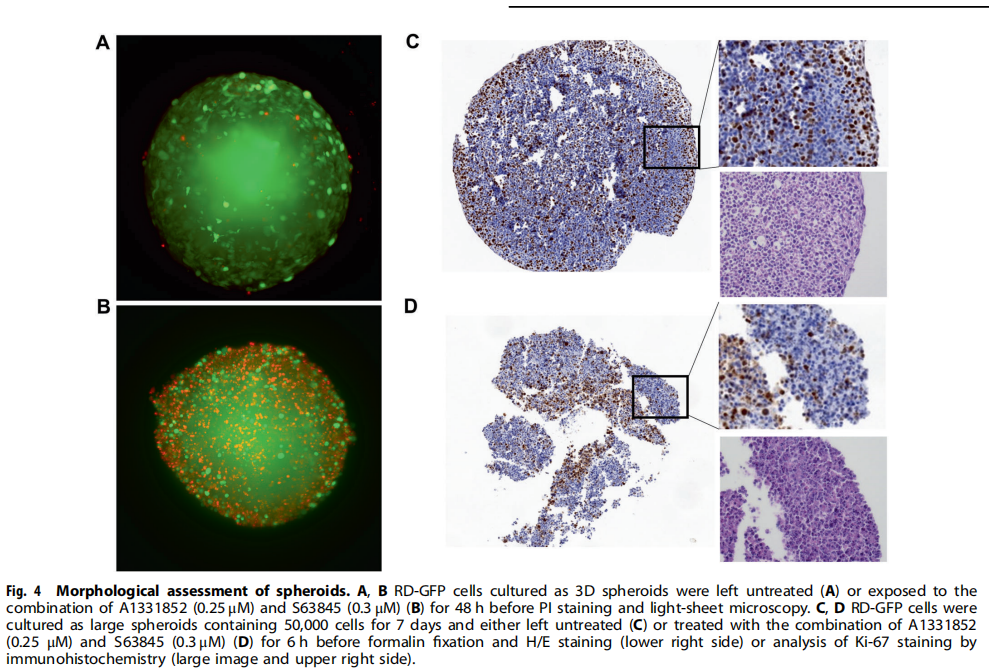
(图四)
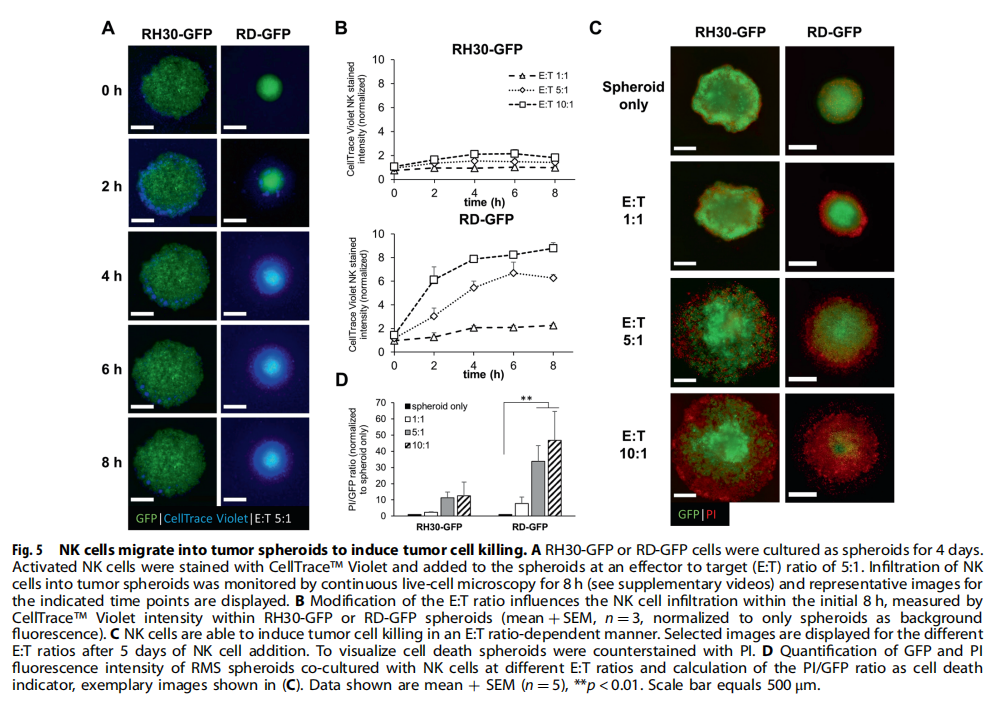
(图五)
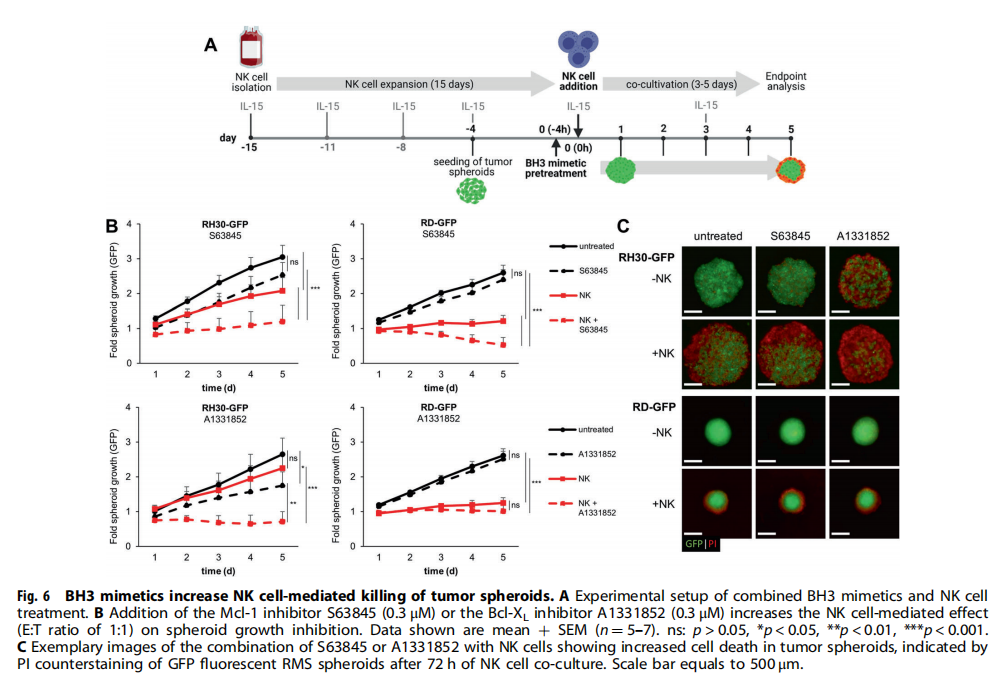
(图六)
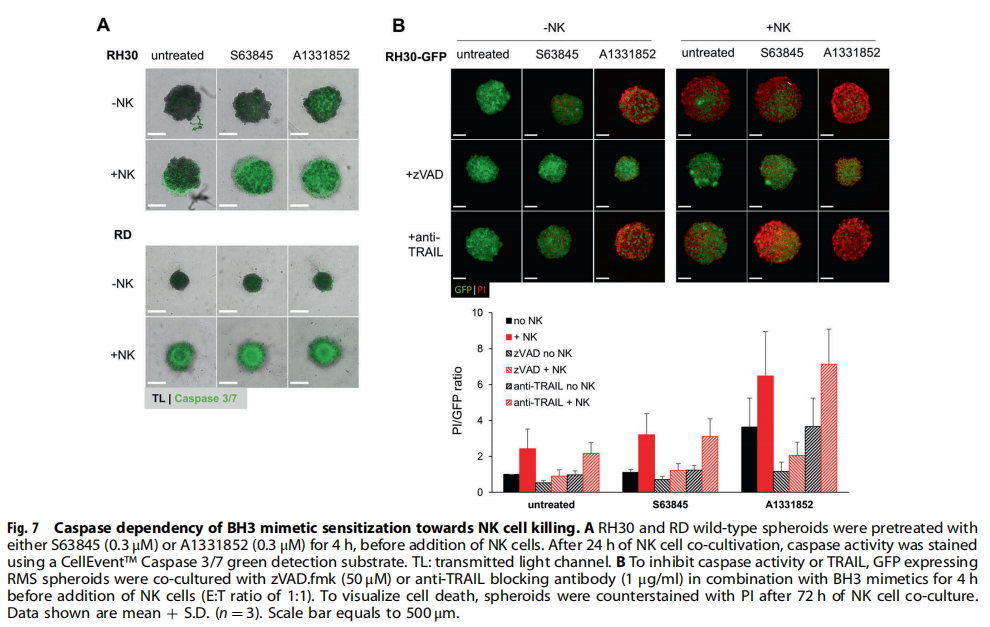
(图七)
结论
总之,本研究表明,NK细胞可能能够与BH3模拟物协同诱导细胞凋亡,特别是在实体瘤内的细胞凋亡抗性区域。BH3模拟物和NK细胞的组合能够在比单独使用任何一种方法更低的浓度下诱导细胞凋亡,因此可能有利于克服BH3模拟物的毒性,同时保持功效。
文章出自:细胞实验外包 想了解更多请关注:http://www.do-gene.com/




